苏糖核酸(threose nucleic acid,TNA)是一种化学结构更简单的人工核酸。TNA可以与互补的DNA、RNA或TNA链,按照碱基配对的原则,形成稳定的双螺旋结构。这个性质为信息在不同遗传系统(例如TNA和RNA)之间传递提供了可能。因此,TNA是一种可能的前RNA遗传物质。
除了天然的DNA和RNA外,科学家们还创造了化学修饰核酸,以克服其固有的缺点,如易受核酸酶介导的降解和化学功能的限制。这些修饰增强了核酸的稳定性和多样性,对于核酸基药物的成功至关重要。科学家们还探索了具有不同糖基、非经典磷酸二酯键和非天然碱基对的合成遗传聚合物,拓展了对核酸结构、性质和功能的认识,并为化学生物学和分子医学提供了独特的合成模块。
各种类型的XNA已在文献中设计、合成和研究。它们具有不同的结构和特性,如环状结构和非环状结构。这些XNA在生物医学应用中具有潜在的重要性,例如抗降解性和对于合成生物学和蛋白质治疗学的应用。其中,TNA作为一种潜在的原始遗传聚合物和分子工具备受关注。
本文分为两部分进行综述。首先回顾了TNA的发现历程,以及其在地球生命早期进化中的角色。其次,探讨了TNA作为分子工具在合成生物学和信息技术中的最新发展,并提出了未来研究的方向和挑战。

1、TNA是一种原始的遗传聚合物
RNA不仅可以存储和传递遗传信息,还可以折叠成复杂的三级结构,具有结合和催化活性。这些特性支持了RNA世界假说,即在现代基于DNA和蛋白质的生命形式出现之前,基于RNA的更简单生命形式曾存在。在一项关于核酸结构化学病因学的重要研究中,Eschenmoser及其同事合成了一系列具有替代糖基的核酸类似物,并探索了它们的碱基配对能力,以解释自然选择RNA作为生命遗传系统分子基础的原因。这项研究推动了TNA的发现,TNA包含由准双轴定位的磷酸二酯键连接的三氟脲基糖环。TNA寡核苷酸不仅与互补的TNA链表现出高效的碱基配对,还与RNA和DNA形成交叉配对,这与之前研究的几种核酸替代品形成对比。
据推测,TNA在早期地球上可能易于获得。研究表明,在适当的益生元条件下,乙醇醛分子可以通过简单的醛缩反应合成苏糖。此外,陨石和彗星中发现了与三糖相关的化合物,这表明它们可能早已存在于地球上。此外,通过选择性益生元合成,可以获得糖核苷和核苷酸。
多种证据支持TNA是RNA的潜在祖先。尽管TNA的重复单元比RNA短一个原子,但它可以与自身形成反平行的沃森-克里克同源双链,与RNA形成异源双链,促进遗传信息交换。研究表明,TNA可以在RNA非酶寡聚化过程中作为模板,并促进RNA的遗传接管。另外,一种依赖RNA的RNA聚合酶核酶已被证明可以在TNA模板上催化RNA单体构建块的连续聚合。
对TNA的碱基配对特性进行了深入研究。在DNA双链中引入单个TNA残基具有微小的结构差异,表明TNA核苷可以很容易地融入DNA的主链。TNA/RNA异源双链在热力学上比TNA/DNA双链更稳定,因为TNA采用A型螺旋几何结构,而DNA不能完全适应刚性TNA主链的约束。TNA/DNA异源双链的稳定性与TNA嘌呤含量有关。
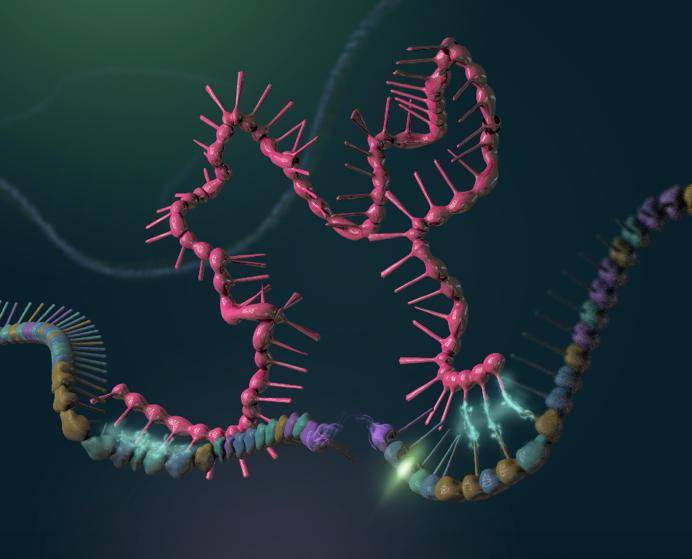
化学简单性和碱基配对特性使得科学家将TNA提出作为潜在的原始遗传聚合物。此外,TNA具有折叠成复杂三级结构的能力(图1),类似于RNA,这也是其作为原始遗传物质的重要特征之一。体外选择技术为评估TNA表达化学表型提供了一种强大的手段,但也存在挑战,例如TNA单体构建块的合成和设计与TNA兼容的酶的研发。
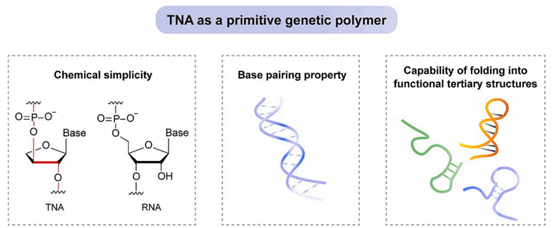 图1 TNA作为原始遗传聚合物的要求
图1 TNA作为原始遗传聚合物的要求
自Eschenmoser等人报道了TNA单体构建块和TNA寡核苷酸的合成方法以来,多个团队已经进行了大量工作来进一步优化这些合成方案。随着简化程序和提高反应收率的发展,现已可以在克尺度上合成TNA单体构建块。方案1简要介绍了从l-抗坏血酸到两种类型的TNA单体构建块的合成路线,其中前者用于固相合成,后者用于酶促聚合。
理想情况下,依赖TNA的TNA聚合酶活性足以支持功能TNA分子的体外选择实验。然而,目前这种酶的活性很难实现,因此更现实的方法是将这种单一酶活性分解为两个单独的酶活性,即依赖DNA的TNA聚合酶和依赖DNA的DNA聚合酶(TNA逆转录酶),这样更容易实现,并且可以支持功能TNA的体外选择。
经过几十年的酶筛选和工程研究,已经发现了几种TNA聚合酶和逆转录酶,包括Therminator、KOD-RSGA、SuperScipt II和Bst DNA聚合酶。这些酶活性使得遗传信息在TNA和DNA之间的传递成为可能,并有助于建立一个高效、可靠的TNA体外选择系统。
2003年,Szostak和Herdewijn报道了能够在DNA模板上催化TNA聚合的DNA聚合酶。随后,Chaput等学者进行了酶工程研究,以提高TNA聚合酶的效率和保真度。在这些研究中,Kod DNA聚合酶的变体Kod-RSGA目前被认为是合成TNA性能最佳的聚合酶,具有快速的反应动力学、改善的全长产物形成和高保真度。
合成化学提供的TNA单体构建模块和酶工程鉴定的TNA兼容聚合酶为TNA的体外选择奠定了基础,使得成功分离TNA功能序列成为可能。2012年,Chaput等人通过体外选择鉴定报道了首个结合人凝血酶蛋白的高亲和力和特异性的TNA适配体,证实了TNA能够形成功能性三级结构,并提供了支持TNA作为潜在原始遗传聚合物的实验证据。2021年,Yu等人报道了首个TNA催化剂的体外选择鉴定,该催化剂促进了RNA连接反应,进一步证明了TNA能够形成催化三级结构,从而支持了TNA作为潜在的RNA祖先的假设。
在一个基于TNA的原始复制系统中,TNA序列逐渐被RNA残基所取代,从一开始的零逐渐增加到最终的100%。通常情况下,这种转变会破坏特定TNA序列的催化功能,使其在被转录为RNA时失去作用。然而,Chaput在2021年的研究表明,当序列从TNA转变为FANA时,催化功能可以得以保持。类似地,Yu最近的研究报道了一个在RNA和TNA主干中都具有催化活性的核酸序列。这些发现表明,在某些情况下,TNA到RNA的转变过程中催化活性可以得到保留,为TNA作为潜在的RNA前体提供了实验支持。
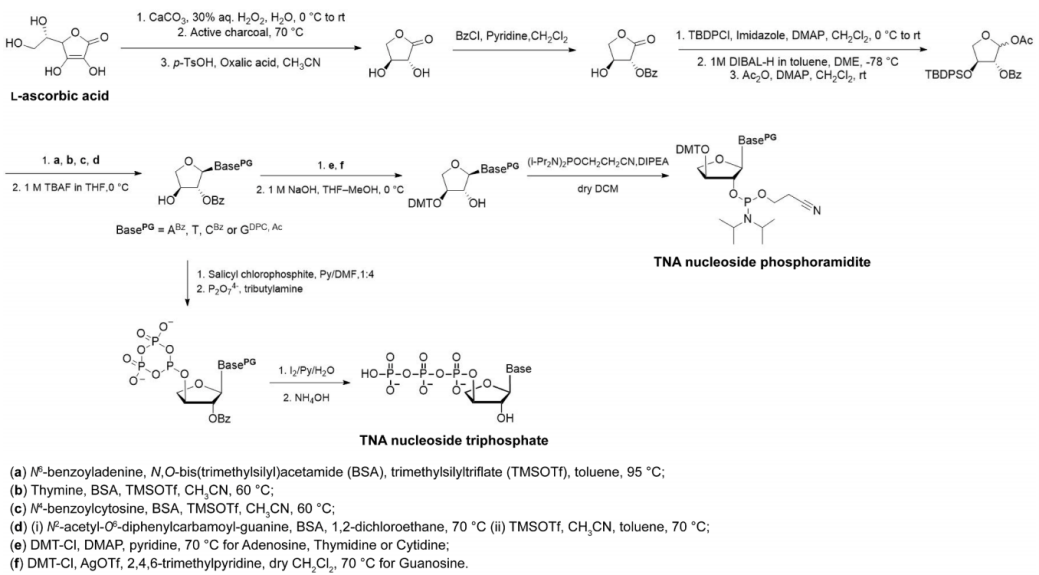 方案1 从l -抗坏血酸开始,合成TNA单体,包括TNA核苷磷酰胺和三磷酸
方案1 从l -抗坏血酸开始,合成TNA单体,包括TNA核苷磷酰胺和三磷酸
2、TNA作为当代分子工具
除了在地球生命起源中可能扮演的角色外,科学家们还发现TNA具有分子工具的应用价值。TNA由于其独特的结构,具有优异的生物和化学稳定性,在模拟的生理条件下(如人血清、胎牛血清和人肝微粒体存在的情况下)经长时间孵育后仍能保持完整。此外,TNA能够保护内部DNA残基免受核酸酶消化,并防止互补RNA链受到核酸酶降解。最近,Chaput等人报道了TNA对酸介导的降解比天然DNA和RNA更具抵抗力。机制研究表明,TNA对低pH环境的特殊耐受性是由于诱导2'-磷酸二酯连锁引起的较慢的去嘌呤速率。
研究表明,相较于天然DNA和RNA,TNA具有出色的生物物理和生化性质,因此在生物医学领域具有广阔的应用前景。本文重点关注TNA作为当代分子工具的最新研究进展,包括TNA适配体、TNA催化剂、TNA线性寡核苷酸(图2)以及TNA信息载体。此外,本文还重点介绍了引入TNA残基以提高DNA和RNA性能的案例。
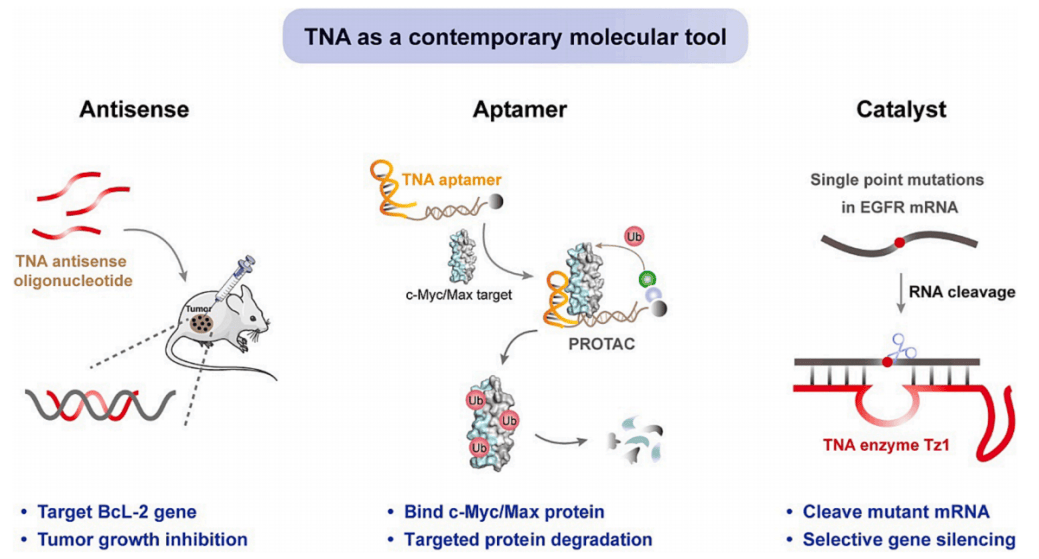 图2 TNA作为现代分子工具
图2 TNA作为现代分子工具
2.1 TNA适配体
适配体是一类单链核酸分子,具备能够形成稳定三维结构并与目标靶标结合的亲和性。然而,裸露的DNA和RNA适配体往往因其对核酸酶的敏感性而在生物医学应用中受到限制。与之相比,TNA适配体则为诊断和治疗应用提供了一种具备生物稳定性的另类亲和试剂。
2012年,Chaput首次报道了一种TNA适体,能够特异结合人凝血酶,从而证明了TNA作为配体结合亲和试剂的潜力。随后,针对不同靶点的TNA适配体陆续被发现。2018年,Chaput通过体外筛选成功发现一种TNA适体,其与HIV逆转录酶(HIV-RT)结合的亲和力达到了纳米摩尔级别(KD为3 nM)。而在2020年,又有报道指出了一种对HIV-RT具有更高亲和力的TNA适配体(KD为380 pM)。除此之外,Chaput还报道了两类TNA适配体,分别能够特异结合SARS-CoV-2刺突蛋白和TNFα。除了蛋白质靶点外,还有针对小分子如赭曲霉毒素A和ATP的TNA适配体被发现。
针对其他治疗相关蛋白(包括PD-L1和c-Myc)的TNA适配体已被研发,并在概念验证的生物医学应用中证明了其有效性。结合PD-L1的TNA适体能够与靶蛋白形成纳摩尔级别的亲和力结合,并有效抑制PDL1与PD-1的相互作用。在结肠癌异种移植小鼠模型中,TNA适配体在肿瘤部位表现出特异性积累,并显著抑制了肿瘤生长。另一项研究中,结合c-Myc的TNA适配体与DNA E-box序列结合,形成了具有高亲和力和生物稳定性的二价结合物。通过进一步连接泊马度胺,可招募E3泛素连接酶,导致目标蛋白的蛋白酶体降解。在两种三阴性乳腺癌(TNBC)细胞系和小鼠TNBC模型中,使用PROTAC分子和CDK4/6抑制剂帕博西尼(Palbociclib)联合治疗可有效抑制细胞增殖和肿瘤生长。
2.2 TNA催化剂
2021年,Yu等人报道了首个具有RNA连接酶活性的TNA酶T8-6。该TNA酶能够催化两个RNA片段的连接,在2',3' -二醇和5' -三磷酸基团之间形成非天然的2'-5'磷酸酯键。T8-6在结合连接处需要四个保守残基(UA|GA,其中|表示结合位点),并且对于底物其他位置的变化具有一定的容忍性。因此,T8-6为研究RNA的结构和功能提供了一种新的分子工具,使得可以将单个2'-5'连接点特异性引入功能性RNA中。例如,通过T8-6将位点特异性的2'-5'连接引入锤头核酶时,产生的变体表现出相当的催化活性。然而,当同样将一个位点特异性的2'-5'连接引入到西兰花RNA适体中时,产生的变体却失去了其荧光促进能力。
2022年,报道了一种具有RNA内切酶活性的TNA酶。其中一种名为Tz1的酶,通过单点取代优先切割表皮生长因子受体(EGFR) RNA底物。Tz1在真核细胞中介导对EGFR突变基因的选择性沉默。其RNA切割催化活性和单点突变识别能力,以及TNA的高生物相容性和生物稳定性,使其成为细胞选择性或等位基因选择性基因敲除的有吸引力的分子工具。
目前报道的所有TNA酶均需要二价金属离子才能正常发挥作用。这些二价金属离子可以帮助TNA酶正确地折叠成所需构象,或直接参与TNA酶的催化反应。当荧光团和猝灭剂偶联到RNA底物的两端时,这种二价金属离子依赖的RNA切割TNA酶可以转化为生物稳定的金属离子特异性荧光传感器。利用这一设计,已成功开发了一种基于TNA酶的Mg2+特异性荧光传感器,可用于活体哺乳动物细胞中的Mg2+成像。
2.3 TNA线性寡核苷酸
除了作为TNA适配体和催化剂通过三级结构的折叠发挥作用外,线性TNA序列还可作为反义寡核苷酸用于基因沉默。这是因为TNA聚合物对其互补的RNA靶点具有显著的亲和力和特异性。此外,TNA寡核苷酸具有高生物相容性、低毒性,无需转染即可被活细胞有效吸收。因此,TNA有潜力作为一种有效的替代生物材料。
2018年,Lo报道了TNA反义寡核苷酸在活细胞中对绿色荧光蛋白(GFP)表现出的沉默活性。随后,反义TNA聚合物被用于靶向BcL-2基因,在异种移植小鼠模型中显著抑制了肿瘤生长。2019年,Lange等人报道了完全由TNA聚合物组成的CpG寡核苷酸序列,该序列激活了B细胞系的先天免疫反应。2022年,Lo等人报道了一种基于TNA的探针,可实时监测细胞内目标microRNA水平,证明了使用TNA寡核苷酸作为生物相容性探针在诊断中的潜力。
2.4 TNA修饰以提高性能
2020年,Ding提出了一种构建具有两个TNA环的末端封闭线性基因的通用策略,以实现基因的高效表达。末端封闭的TNA环修饰增强了线性EGFP基因抗外切酶和血清消化的稳定性,从而促进了该基因在真核细胞中的高效和持久表达。
此外,TNA已被引入到RNA切割DNA酶(DNAzyme)中,以提高其生物稳定性。经典的DNAzyme 10-23是一种依赖Mg2+的DNA催化剂,可位点特异性地切割其RNA底物。然而,其催化活性较差,生理条件下生物稳定性差,限制了其作为基因沉默剂用于疾病治疗的应用。2021年,Chaput将FANA和TNA两种不同的化学型引入到10-23中,获得了性能更好的XNA修饰的10-23(X10-23)。X10-23的底物结合臂完全由FANA组成,催化核心内的两个残基(G2和U8)也被FANA取代。重要的是,X10-23每个末端的TNA残基显著提高了生物稳定性,并有效保护了寡核苷酸不被核酸酶酶切。在存在人肝微粒体、50%人血清或蛇毒磷酸二酯酶的条件下,X10-23仅被可忽略的降解,而DNAzyme 10-23在相同条件下表现出明显的降解。当X10-23靶向癌细胞内源性致癌基因KRAS时,可有效降低靶mRNA的表达水平和蛋白丰度。
受到X10-23催化活性和生物稳定性提高的启发,Spitale和Chaput进一步利用X10-23来区分RNA中等位基因特异性单核苷酸突变。通过设计和使用X10-23靶向KRAS基因中与G12V突变相关的序列,实现了对G12V特异性的高效靶向RNA切割,从而减少了下游信号的表达水平。
最近,对TNA修饰的小干扰RNA (siRNA)进行了系统评估,结果表明,TNA位点特异性修饰显著提升了siRNA的稳定性和作用效力,减轻了脱靶效应,从而为siRNA疗法的安全性和有效性带来了提升。
2.5 TNA作为数字信息载体
DNA因其低能量、高密度的存储信息能力成为一种备受欢迎的数据存档材料。然而,当DNA被普遍存在的核酸酶或化学反应破坏时,它很容易丢失信息。由于TNA具有独特的2',3'连接的磷酸二酯骨架结构,它可以补偿DNA的生物和化学不稳定性。Chaput在一项概念验证研究中证明,TNA作为信息存储的软材料,提供了一种生物稳定的DNA替代品。在这项工作中,数字信息首先以DNA格式编码,然后通过合成相应的TNA寡核苷酸将其转化为TNA。随后通过将TNA逆转录回DNA进行测序和解码来恢复这些信息。具体来说,来自文本和图像文件的数字信息首先被忠实地写入TNA并以单链寡核苷酸的形式存储。随后通过逆转录、PCR扩增和深度测序成功检索和解码信息。在人血清、人肝微粒体和蛇毒磷酸二酯酶存在下,TNA寡核苷酸未被消化,存储的信息被完全恢复,而DNA样品则被完全破坏。该研究强调了TNA作为生物稳定的信息大分子在数据存储方面的价值。
结论与展望
多年研究提供了多种证据来支持TNA作为潜在原始遗传聚合物的观点,包括TNA适配体和催化剂的鉴定。未来研究将探索功能性TNA分子是否能够进化,以识别与益生元相关的小分子,并促进生命起源所需的化学反应。此外,TNA优越的生物稳定性促使科学家们开发TNA作为一种有前途的现代分子工具,用于各种应用。此外,化学修饰的核碱基对TNA进行进一步功能化,可以合成生物稳定性和化学功能增强的核酸类似物。未来的合理设计和定向进化必将丰富TNA酶工具箱,促进TNA在实验室和各个领域的发展。(来源宋杰课题组)