在药品安全管理的关键环节,药品不良反应的及时报告扮演着至关重要的角色。药品上市许可持有人及药品监管机构紧密合作,对收集到的药品不良反应报告数据进行深入剖析,旨在开展全面而严谨的药品安全性评价。近日,河南省药学会主导制定了《国家药品不良反应监测系统个例报告信息上报规范》(T/HENANPA 012—2024),并正式实施。这一里程碑式的规范不仅明确界定了国家药品不良反应监测系统中涉及的关键术语与定义,还详细规定了个例药品不良反应/事件报告信息的标准化收集流程、信息处理的规范性要求、信息填写的准确性原则以及信息上报的规范内容。
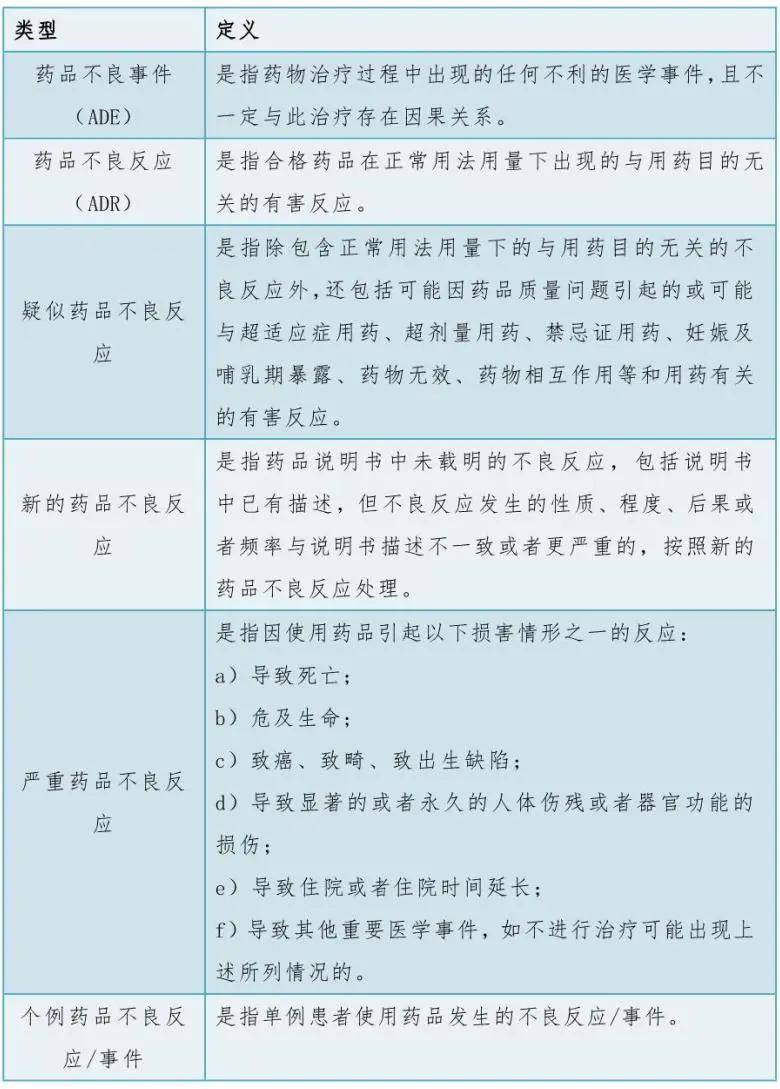
一、PV专业人员必知的药品不良反应上报关键术语
在药品安全监管的广阔领域中,药物警戒(Pharmacovigilance,PV)作为核心环节,对于保障公众用药安全具有不可估量的价值。作为PV专业人员,您身处这场守护生命健康的战斗前线,掌握并熟练运用药品不良反应(ADR)上报的相关术语,不仅是专业素养的体现,更是高效履行职责、促进药物安全使用的重要基石。本文将为您梳理了PV工作中不可或缺的关键术语,详见下表:
二、个例药品不良反应/事件的上报流程
根据《药品不良反应报告和监测管理办法》第十五条第一款的明确规定,药品生产、经营企业及医疗机构在获知或发现可能与用药相关的任何不良反应时,应遵循以下高效、规范的上报流程:
(1) 及时识别与记录:首先,相关单位需立即识别并记录可能的不良反应事件,确保信息的准确性与完整性。这包括但不限于患者的基本信息、用药史、不良反应症状及发生时间等。
(2) 选择上报渠道:随后,根据自身的技术条件选择最合适的上报方式。若已具备在线报告能力,应直接通过国家药品不良反应监测信息网络进行报告。该网络提供了便捷、安全的在线平台,便于快速传递信息。
(3) 在线报告操作:对于选择在线上报的单位,需访问指定的国家药品不良反应监测信息网络报告网址,并登录到相应的界面。在界面上,按照提示逐步填写不良反应事件的详细信息,确保每一项内容都准确无误。
(4) 纸质报表备选:若因技术或网络条件限制无法实现在线报告,相关单位应准备并填写纸质报表,详细记录不良反应事件的所有相关信息。随后,将这份报表提交至所在地的药品不良反应监测机构,由该机构代为完成在线报告。
(5) 确认与追踪:上报完成后,相关单位应保留好上报记录及任何相关原始资料,以备后续查询或审核之需。同时,密切关注不良反应事件的后续发展,如有新情况或进展,应及时进行补充报告。
1. 登入网址:
国家药品不良反应监测信息网络报告网址https://www.cdr-adr.org.cn/drug_1/adrReport_1/
2. 登入界面:
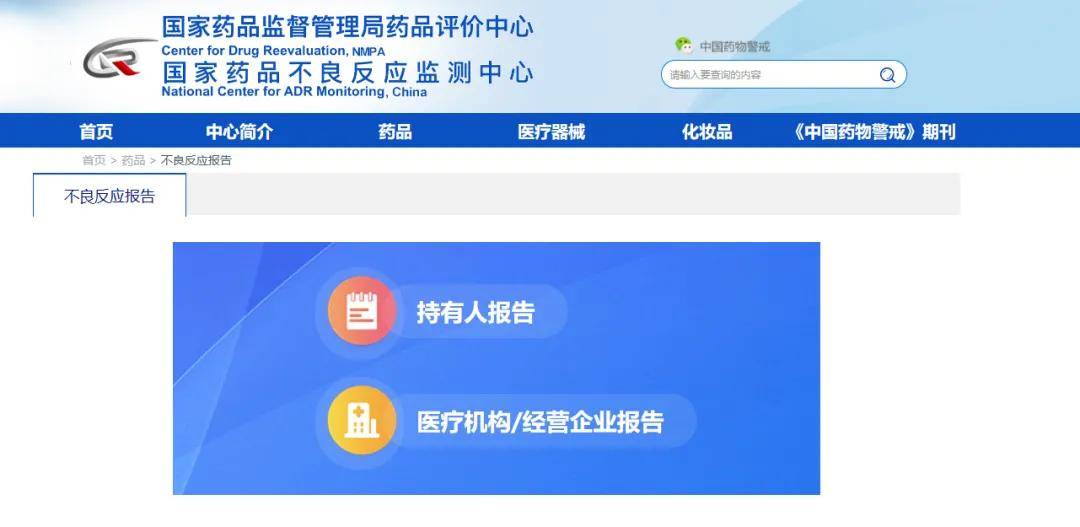
3. 上报原则
药品不良反应/事件的上报需由经培训的报告人针对可识别患者收集信息,遵循“可疑即报”原则,确保信息的真实、准确、完整,并保留原始资料以防重复上报。
4. 信息收集处理方法
信息收集处理方法主要划分为三大类型:客观获得信息、询问获得信息及判断获得信息。以下是对这三种信息收集处理方法的精炼定义及概览:


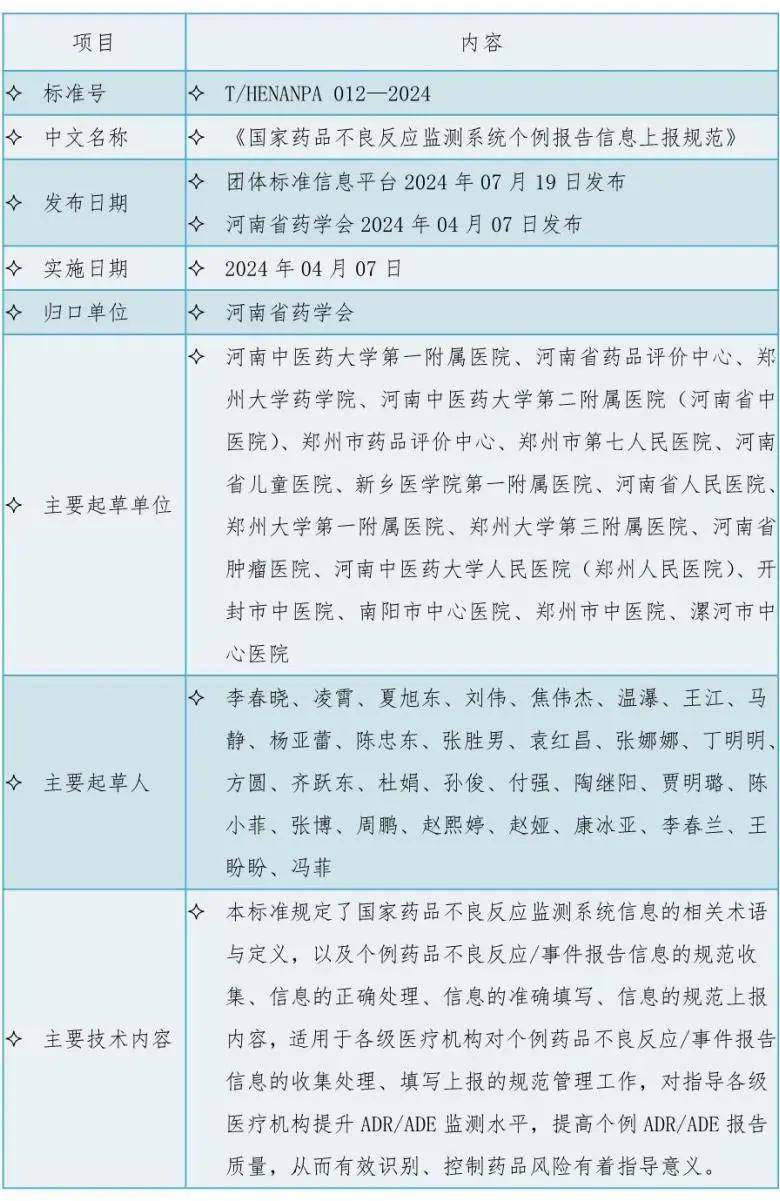
三、《国家药品不良反应监测系统个例报告信息上报规范》标准信息
四、点评
综上所述,《国家药品不良反应监测系统个例报告信息上报规范》的发布,有利于中国药物警戒行业的进步发展。在药品不良反应/事件的信息收集中,我们应遵循一套系统而高效的处理方法。传统的纸质上报和管理不仅效率低下,而且难以满足行业日益加强的监管,并限制好药的社会推广和应用。随着我国医药行业的快速发展,药物警戒业务数字化和智能化已成为大势所趋。药物警戒软件通过自动化和智能化手段,极大地提升了不良反应(ADR)报告的效率和准确性,使企业能够全面管理个例安全性报告(ICSR),具备智能化数据采集、便捷的数据分析;高效地收集和处理来自患者、医生、临床试验等多方的不良反应信息;通过网关技术直接在线提交ICSR报告,并获得国家网络平台的在线反馈;进一步支持信号挖掘、风险管理的功能,满足药企药品安全数据监控和法规监管的需求,帮助企业更好地开展药物警戒管理。
 点击查看 辛格迪 药物警戒系统(PVS)
点击查看 辛格迪 药物警戒系统(PVS)
药物警戒系统(PVS)