在分子生物学领域,质粒提取是一项至关重要的实验技术,为研究者提供了从复杂的生物体中提取质粒的高效手段。本文将系统介绍质粒提取实验的原理、实验流程,以及实验中可能遇到的技术难题,旨在为实验室科研者提供一份详实的操作指南。
质粒提取原理
质粒是一种环状小分子DNA,位于细胞内,常被用作DNA重组的载体。具备自身复制起点,独立于细胞主染色体之外。质粒DNA携带部分基因信息,通过基因表达影响宿主细胞的表型。在DNA重组中,可通过连接外源基因构建重组体,其中质粒或经改造的质粒充当关键角色。
应用方面
(1)、快速纯化质粒
(2)、用于测序、体外转录与翻译、限制性内切酶消化、细菌转化等分子生物学实验
基本步骤
(1)细菌的培养和质粒的扩增
(2)细菌菌体的裂解
(3)质粒DNA的纯化
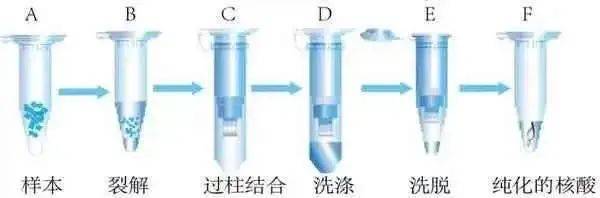
一、摇菌培养
1、取经过正确鉴定的克隆菌液,在LB固体平板上进行涂布(该平板含有质粒扩增所需的培养基)。
2、将平板置于37℃的恒温培养箱中,进行培养12-17小时,直至形成可见的菌落。
3、在经灭菌处理的15毫升离心管中加入5毫升含有抗生素的LB液体培养基,并进行编号标记。
4、从单个克隆菌团中挑选,并将其放置于预先标记好的液体培养基中,每个培养基放置一个菌落。
5、在37℃、180rpm的条件下,进行振荡培养过夜。
二、收获细菌并裂解
1、将经离心扩增处理的良好菌液,按照说明书指引进行重悬,并转移至1.5毫升的离心管中。
2、利用质粒小量抽提试剂盒,按照说明书的规定进行质粒提取操作。
3、将细菌进行高速离心1分钟,以完全清除上清液。
4、加入250微升的RB溶液,通过振荡器充分悬浮细菌。
5、加入250微升的LB溶液,迅速上下颠倒10次,促使细菌裂解,然后在室温下静置2分钟。
6、加入250微升的NB溶液,立即上下颠倒10次,确保充分中和,在室温下静置2分钟。
7、在室温下,以1500rpm的高速进行离心,时长为15分钟。
8、将吸附柱置于收集管内,将离心得到的上清转移至吸附柱,室温下以15000rpm的高速进行离心,持续30秒。
9、弃去废液后,将吸附柱放入收集管,向吸附柱中加入700微升的WB溶液,再次以15000rpm的高速进行离心,持续30秒。
10、重复上述步骤一次。
11、将吸附柱放入干净的1.5毫升离心管中,添加30-50微升预热的Elution Buffer,室温下放置2分钟,然后以高速离心1分钟。
12、对样品进行电泳检测:使用1%琼脂糖凝胶电泳,上样量为2微升,在紫外灯下观察,最亮的带表示超螺旋形态,可一定程度上反映质粒提取的纯度。
三、质粒的纯化
1、取先前提取的质粒,置于1.5毫升的离心管中,并加入其1/10体积的3mol/L无菌乙酸钠溶液。
2、添加2倍体积的无水乙醇,将混合物放置于-20℃冷冻4-6小时或过夜。
3、在4℃下,使用高速离心机以14000rpm进行离心,持续20分钟。
4、弃去上清液,使用70%乙醇进行两次洗涤。
5、空气干燥,可将样品放于超净工作台中晾干。
6、加入200微升的无菌水溶液,使沉淀溶解,即可得到质粒溶液。
7、使用紫外分光光度计测量质粒的浓度和产量。
测量OD260和OD280的值:质粒DNA浓度=OD260×50×稀释倍数(μg/mL)。
提取方法
质粒DNA的提取方法主要有碱裂解法、煮沸法、酚氯 仿裂解法。跟据不同的实验目的和仪器设备择取不同的实验方案。
实验流程
一、实验方法及原理:(碱裂解法)
碱裂解法是基于DNA的变性与复性差异而达到分离目的的。碱性使质粒DNA变性,再将pH值调至中性使其复性,复性的为质粒DNA,而染色体DNA不会复性,缠结成网状物质,通过离心除去。
二、实验材料、试剂、仪器:
大肠杆菌、Tris-Hcl、EDTA、葡萄糖、NaOH、KAac、NaAc、异丙醇、溶菌酶、酚:氯 仿、无水乙醇、LB培养基、超净工作台、培养箱、摇床、恒温水浴锅、台式离心机、取液器、低温冰箱、冷冻真空干燥机、电泳仪、水平电泳槽、紫外观测仪。
三、实验步骤:
1、细菌繁殖:LB培养基,2 ml/20 ml,37℃,200 rpm,摇一摇,过夜。
2、离心10 min,5 000 rpm, 4℃;弃上淸液。
3、沉淀(菌体细胞)预冷的TES缓冲液洗涤,离心10 min,5 000 rpm, 4℃,加入预冷的1 ml Solution I,冰浴10 min。
4、重新悬浮,加入150 ul溶菌酶母液,室温放置5 min。
5、加入1.2 ml Solution II, 冰浴5 min。
6、加入0.9 ml预冷乙酸钾,混匀,离心10 min,12 000 rpm,4℃。
7、加入1.5 ml异丙醇,-20℃冰箱内放置15 min。
8、离心10 min,12 000 rpm,4℃。
9、取沉淀,悬于400 ul TE缓冲液中。
10、加入40 ul,3 M NaAc。
11、酚/氯 仿,抽提,乙醇沉淀。
12、离心10 min,12 000 rpm,4℃。
13、取沉淀,冷冻干燥,再悬浮于50 ul TE缓冲液中。
14、电泳检测提取DNA的质量。
常见问题
一、质粒提取的得率低或无质粒
1、菌体老化情况:重新进行筛选,并挑选年轻的菌落用于液体培养。
2、质粒拷贝数较低:选择高拷贝的新菌体进行筛选。
3、碱裂解效果不足:若收集的菌体含量较高,可根据需要适度增加碱裂解液的1、2、3号成分的含量。
4、乙醇残留或漂洗不彻底:确保充分清除乙醇残留,加强漂洗步骤。
5、洗脱处理不妥:调整洗脱液的添加量,避免加入过多或洗脱时间过短。
二、质粒的纯化不足
1、混有RNA,RNase A处理不彻底。
2、混有基因组DNA。避免加入溶液2,3时剧烈震荡。如果加入溶液P2后过于粘稠,无法温和混匀,请减少菌体用量。细菌培养时间过长也会导致细胞和DNA的降解。