点击蓝字 关注我们
投资要点

创新转型成效显著,营收伴随新品上市保持20%以上高增速:随着先必新、恩维达等创新药快速放量,公司2022H1总收入达27.0亿元(同比27.3%),其中创新药收入约17.7亿元(同比44.8%),占收入比重达65.4%,预计2024年比重达80%,创新转型成效显著。2023年五款新药开始商业化和报产,将支撑未来三到五年20%以上增速:①曲拉西利(25亿峰值) ②SIM0417(3CL新冠特效药) ③先必新舌下片(30亿峰值)④恩度恶性胸腹腔积液适应症(所有适应症15亿峰值) ⑤赛伐珠单抗(15亿峰值)。
自研与合作双轮驱动,持续推进差异化研发管线:公司聚焦神经、自免和肿瘤三大领域,并前瞻性布局未来有重大临床需求的疾病领域。先声自主研发与合作研发协同,Liscense-in与liscense-out模式并行,快速勾勒产品矩阵。目前公司有丰厚的创新药研发管线近60项,目前已上新药市6款,处于临床阶段的管线19项(III期8项、II期5项、I期6项),创新药储备丰厚,为先声持续创新转型贡献力量。
3CL特效药国内获批上市,2023年开始将贡献可观收入:先诺欣™(SIM0417)是先声与上海药物所合作的一款3CL靶点新冠特效药,其用于治疗轻中度COVID-19成年感染者 II/III期注册研究已于12月18日完成全部患者入组,2023年1月16日新药上市申请(NDA)获NMPA以药品特别审批程序受理,并于2023年1月29日附条件获批上市,成为首个上市的3CL国产新冠特效药,预计2023年开始将贡献可观收入。
盈利预测与投资评级:随着上市产品持续放量及新产品的报产(不考虑新冠药SIM417收入),2022-2024年营收预测为62.5/78.5/108.1亿元,2030年销售峰值预测约为220亿元,归母净利润预测为6.88/11.41/15.56亿元,当前市值对应2022-2024年PE为41/25/18倍。由于1)创新药收入占比快速提升,增长动力强劲;2)业绩增长空间大,保持较高增速;3)仿制药收入逐渐企稳回升。首次覆盖,给予“买入”评级。
风险提示:新药研发及审批进展不及预期;政策影响对产品价格的不确定性;核心技术人员、高管流失风险。


1. 先声药业:加速推进创新转型,差异化管线布局丰富
先声药业是一家创新与研发驱动的制药公司,拥有研发、生产及专业化营销能力。公司主要专注于肿瘤、中枢神经和自身免疫三大疾病治疗领域,以自主研发与合作研发双轮驱动,差异化布局创新药研发管线近60项,创新转型成效显著。
1.1. 公司发展历程
先声药业有限公司成立于1995年,发展至今已经成为集研发、生产、商业化为一体的制药公司,正在快速向创新与研发驱动转型。公司先后在上海、南京、波士顿三地设立创新研发中心,一方面积极秉持新药自主创新研发策略,另一方面与众多国内外领先药企和生物科技公司成为战略合作伙伴,拓展产品管线。2020年公司于香港交易所挂牌上市(2096.HK)。

1.2. 核心管理团队技术背景深厚,管理经验丰富
公司创始人、执行董事、董事长兼首席执行官任晋生先生,主要负责公司重大业务及战略运营决策。任先生1982年毕业于南京中医药大学中药专业,2003年获澳洲麦考瑞大学经济学硕士学位。任先生曾于1982-1992年就职于启东盖天力制药公司,历任技术员、副总经理;1992-1995年担任江苏医药工业公司部门经理。凭借近40年的行业经验,任先生对整个医药产业有深入的了解和丰富的管理经验。
公司的核心管理团队均是有深厚技术背景和丰富行业经验的佼佼者。公司执行董事兼常务副总裁唐任宏,南洋理工大学分子细胞生物学和免疫学博士,加州大学旧金山分校肿瘤研究中心博士后研究员,曾在诺和诺德和阿斯利康等知名药企从事创新研发管理工作10余年,目前主要负责上海创新中心的全面管理工作及集团的创新药临床前研发管理工作;公司高级副总裁Kevin Oliver,剑桥大学病理学博士,曾在Merck负责研发和BD工作超20年,目前负责全球业务发展与授权/并购工作;公司高级副总裁Danny Chen,美国俄亥俄州立大学药学博士,曾在辉瑞、赛神等知名企业负责临床药理和转化医学工作,2022年2月加入先声药业,主要负责公司转化科学与神经领域研发的管理,以及北京创新中心研发团队的组建与管理。

1.3. 自主与合作双驱动研发策略
自主研发:目前公司自主研发能力成熟,覆盖小分子与生物药两大板块,涵盖整个药物开发流程。截至本报告日期,公司研发部门人员数量约1100人(含博士约130人,硕士约520人),超10%的成员为来自海外知名药企或院校的科学家或前研发人员。
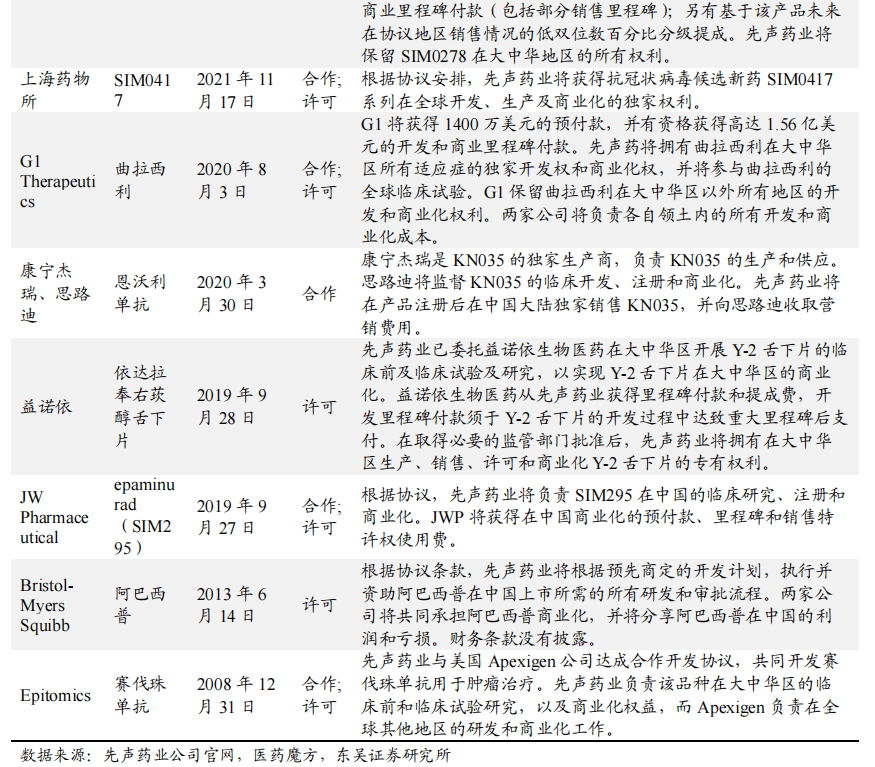
合作研发:公司与众多国内外领先制药企业和生物科技公司建立合作关系,充实产品管线。合作伙伴包括:(1)跨国制药企业,如BMS、Amgen等;(2)国内外生物技术公司,如Idorsia,AImirall,Apexigen、JW Pharmaceutical、G1 Therapeutics、Vivoryon Therapeutics N.V、江苏康宁杰瑞、思路迪医药等;及(3)著名国内外大学及其他研究机构,如中科院上海药物研究所,清华大学等。

1.4. 差异化管线布局丰富,持续推进创新研发
研发支出不断增加,加速推进创新转型。2017年至2022H1公司研发支出大幅增加,2021年研发投入约14.17亿元,占收入比例自2017年的5.4%增加至28.3%,同比增加24.1%;2022H1研发投入6.5亿元,同比增长约3.9%,研发费用率约24.1%。目前公司拥有创新药研发管线项目近60项,处于临床阶段的创新药管线19项(III期临床6项、II期临床6项、I期临床7项),2022H1创新药收入占总收入比例达到65.6%,2017年以来持续增长,先声创新转型成效明显。
公司研发战略重点聚焦于神经系统疾病、肿瘤疾病和自身免疫疾病,差异化布局三大优势治疗领域,产品管线丰富且推进速度快。


1.5. 市场推广销售能力卓越,药品生产能力强大
公司拥有覆盖全国的营销网络和领先的商业化能力。截至2022年6月30日,公司拥有4个营销事业部,共有销售人员近4,400名,遍布中国31个省、市及自治区,覆盖全国超2,700家三级医院,约17,000家其他医院及医疗机构,以及超过200家大型的全国性或区域性连锁药店。

公司目前有五个药品生产基地,均通过了中国GMP认证(部分车间已通过了欧盟GMP认证或美国FDA检查),覆盖大分子、小分子药物原料和制剂一体化的制药能力,并按照国际高标准进行生产和质量管理。
(1)南京大分子药品生产基地作为先声药业生物药开发和生产中心,公司共设计有4条2,000L规模的原液生产线,致力于生物创新药的自主开发,以及与国内外头部生物药企的合作开发。 (2)南京小分子药品生产基地位于南京江北新区生物医药谷,占地14.6万平米,建有注射剂、口服固体、口服液体、以及吸入制剂等车间,是江苏省最早通过新版GMP认证的制药企业,其中口服固体车间通过了美国FDA检查。 (3)烟台生产基地位于烟台经济技术开发区,占地4.8万平米,是基因工程生物制品、蛋白药物制造基地。 (4)海口基地位于海口高新区药谷工业园,占地16.6万平米,建有注射剂、口服固体和外用凝胶等车间,该基地的质量系统通过了美国FDA的现场检查,其蒙脱石车间通过了EU GMP认证,产品出口欧洲,并且进入法国医保。澄迈基地位于海南省澄迈县,占地26.1万平米,建有口服抗生素制剂等车间。 (5)芜湖基地位于芜湖三山经济开发区,占地2万平米,主要生产独家术中缓释植入剂型。
2. 中枢神经领域:重点布局脑卒中,拓展神经科学领域
在中枢神经板块,公司针对脑卒中全病程布局。公司以先必新为核心产品,将Y-2舌下片作为其病程补充产品,同时探索创新机制探索,如SIM307(AQP4)、SIM339(DAPK1)等。公司还通过合作逐步向高挑战适应症方向拓展,如与Vivoryon合作的阿尔兹海默症的口服小分子谷氨酰肽环转移酶(QPCT)抑制剂SIM408,以及与瑞士Idorsia公司合作双食欲素受体拮抗剂新药daridorexant,快速切入抗失眠领域。

2.1. 中国卒中负担最沉重,治疗需求迫切
2.1.1. 国内脑卒中流行及治疗现状
脑卒中,别名“中风”、“脑血管意外”,属于急性脑血管疾病,指由于脑部血管突然破裂或因血管阻塞导致血液不能流入大脑而引起脑组织损伤的一组疾病。脑卒中主要分为两类:缺血性脑卒中和出血性脑卒中,其中急性缺血性卒中(AIS)为最常见的卒中类型,约占全部脑卒中的60%-80%。
中国脑卒中患者,具有高发病率、高致残率、高死亡率、高复发率、高经济负担五大特点,市场需求逐年增加。脑卒中给中国带来的社会经济负担达到1000亿元/年,2018年中国缺血性脑卒中住院总费用达654.3亿元,缺血性卒中和出血性卒中患者人均住院费用分别为人民币9410元和19149元,相比2008年分别增长56%和125%。

缺血性脑卒中治疗策略。目前再灌注治疗为主要治疗方案,其原理为恢复缺血区血流、改善脑血循环,以静脉溶栓、血管内治疗为主,其他疗法包括抗血小板治疗、抗凝治疗、降纤治疗以及改善微循环药物治疗。然而,目前静脉溶栓与机械取栓等主要治疗方案存在应用限制和治疗缺陷: (1)应用范围较窄,时间窗较短;(2)可能发生脑再灌注损伤,使神经受损。
神经保护剂优势显著:(1)可作用于脑卒中发生后的不同阶段,可与静脉溶栓药联用,提高神经元对脑缺血的耐受性,全方面、多层次延缓神经元的死亡,延长患者的治疗窗.(2)减少传统再灌注治疗造成的脑组织损害并改善神经功能缺损,最终促进患者的功能恢复。因此,基于静脉溶栓与机械取栓的应用限制和疗效局限性,神经保护剂的优势显著,在脑卒中领域中会具有更广阔的应用空间。

2.1.2. 缺血性脑卒中市场竞争格局
石药集团的恩必普(丁苯酞)为1类新药,旨在治疗急性缺血性脑卒中,通过降低花生四烯酸含量,抑制谷氨酸释放,抑制自由基和提高抗氧化酶活性等,起到神经保护作用,属于脑侧支循环改善类药物,是公司独家拳头产品。恩必普分为两种剂型,目前两大产品均为全国医保目录谈判品种,年销售额超65亿元。
石药集团于2022年2月以1.54亿元收购铭康生物,获得新一代溶血栓新药铭复乐(注射用重组人TNK组织型纤溶酶原激活剂)。铭复乐于2015年获批上市,用于发病6小时以内的急性心肌梗死患者的溶栓治疗,目前针对缺血性卒中新适应症已推入Ⅲ期注册临床,即将申请上市,潜在销售峰值20亿元。
先声药业于2020年7月上市的 先必新(依达拉奉右莰醇注射用浓溶液),属于神经保护药物。未来将充分替代必存的市场份额,基于公司必存之前的销售峰值(38亿元)和国内每年新发超过540万的卒中人群,可以预判先必新销售峰值有望比肩石药的恩必普,成为50亿级别的大单品。 先必新舌下片(前称Y-2舌下片)口服制剂,搭配先必新组成序贯疗法,利于患者获得完整疗程,预计可以成为30亿的大单品。

2.2. 先必新:新型双靶点神经保护剂,近5年全球脑卒中治疗唯一获批新药
先必新于2020年7月29日获得上市批准,并在2020年12月28日录入最新医保目录。先必新从批件到发货,用时仅13天,为小分子业内最快,从发货到全国覆盖,用时仅80个小时;产品获批到纳入医保,用时仅5个月。2021年3月1号国家新医保执行后,截至2021年底已覆盖近2400家医疗机构, 在2021第一个完整财年收入达14.78亿元,2022上半年收入约10亿元,销售增长强劲。
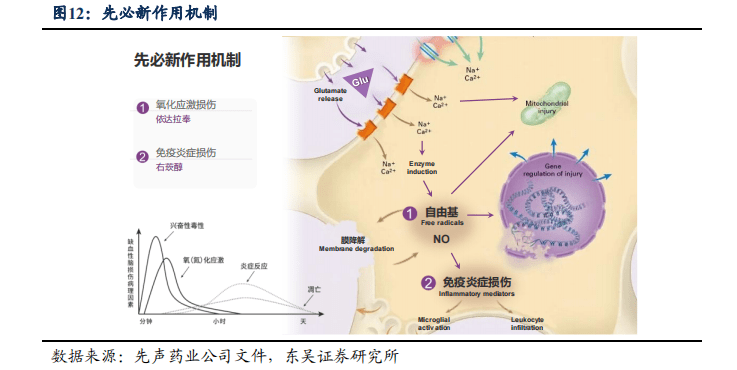
2.2.1. 先必新依达拉奉和右莰醇科学配比,对患者病情的改善效果显著
先必新以4:1的配比组合科学配伍了两种活性成分-依达拉奉和右旋莰醇。二者联合作用能够有效阻断脑缺血导致的神经细胞凋亡和组织坏死的级联反应,保护血脑屏障,减轻脑水肿,缓解缺血再灌注损伤,并阻止了患者脑组织的快速坏死,依达拉奉和右莰醇表现出对脑缺血损伤显著的协同治疗效果。
TASTE临床研究数据显示依达拉奉右莰醇疗效明显高于依达拉奉单方治疗:TASTE为一项随机、双盲、头对头的III期临床研究,入组约1200名急性缺血性脑卒中患者,主要疗效终点为第90天mRS评分≤1分的患者比例(mRS为改良Rankin量表,用来评估脑卒中后患者的神经功能恢复情况,0分表示无症状,5分表示严重的残疾)。结果显示:依达拉奉右莰醇组mRS评分≤1的患者比例显著高于依达拉奉组,分别为67.18%和58.97%,两组差异为8.21%(OR:1.42,95%CI:1.12~1.81,P=0.0004)。两组临床安全性相似,但依达拉奉右莰醇可将现有治疗时间窗从24小时大幅延长至48小时,意义重大。

2.2.2. 先必新市场规模预测,2030年峰值销售额预计达到50.8亿元
- 潜在患者人数假设: 根据弗若斯特沙利文报告测算:中国脑卒中存量患者人数以每年约4.5%-4.8%的速度增加,预计2025年将达到2069万人,2030年将达2578万人,其中缺血性脑卒中患者人数约占70%,年复发率为17.7%;2019年我国新发脑卒中患者约460万人,并以每年8.7%的速度上升,预计2025年新发脑卒中患者人数达759万人,2030年将达1153万人,其中约70%患者为缺血性脑卒中;我们假设每年缺血性脑卒中发病患者数为复发患者与新发患者的总和。
- 渗透率假设: 先必新借助必存(依达拉奉)积累的销售渠道,在2021年第一个完整销售年实现产品入院2400家,覆盖近50万卒中患者,渗透率为8.0%;随着先必新的循证医学证据和实际临床疗效得到权威与医患的认可,我们假设2022-2025年保持较高的增速,随后在2026年后放缓保持,预计2025年渗透率达到峰值约27%。
- 药物价格假设: 2020年12月先必新首次纳入医保目录,进入医保后,平均日治疗费用约310元(每日一盒),实际使用平均10天为一个疗程,用药总金额约为3100元;2022年底将进行医保续约谈判,由于目前缺血性卒中领域没有更多创新药物选择,价格或存在小幅度下降约20%。随后几年,先必新每两年降价一次,每次降幅约10%。
- 用药时长与剂量假设: 先必新成人推荐剂量为每次15 ml(先必新每支5ml(10mg:2.5mg)),每日两次;根据《中国卫生健康统计年鉴》及公司相关信息,先必新治疗缺血性脑卒中患者平均住院时长为10天,尽可能在发病后24小时内开始给药。
销售峰值预测:基于上述进行销售测算,我们预计先必新将在2030年达到销售峰值,销售额约50.8亿元。
销售峰值预测:基于上述进行销售测算,我们预计先必新将在2030年达到销售峰值,销售额约50.8亿元。

2.3. 先必新舌下片:以更便捷的给药方式照顾卒中患者全病程治疗
先必新舌下片(Y-2舌下片)是先声药业与烟台益诺依生物医药科技有限公司、首都医科大学附属北京天坛医院合作开发的新型舌下给药复方制剂,是已上市一类新药先必新(依达拉奉右莰醇注射用浓溶液)的口服剂型。Y-2舌下片由依达拉奉和右莰醇两种活性成分组成的固体制剂(每片含依达拉奉30mg,右莰醇6mg),并通过舌下给药发挥抗炎及改善血脑屏障通透性等药效,从而减轻急性缺血性脑卒中引发的脑神经损伤。目前Y-2舌下片治疗急性缺血性卒中的中国III期临床试验,已于2022年5月4日完成全部914例受试者入组,并于2022年12月1日宣布III期临床达预期疗效终点,预计于2023年H1申报NDA。

2.3.1. 舌下给药方式便利且及时,为卒中患者赢得更长治疗窗口
Y-2舌下片的优势:(1)舌下迅速崩解,通过舌下静脉丛吸收,进入中枢发挥抗炎、抗自由基和保护血脑屏障等药效。(2)由舌下粘膜直接吸收,可避免口服药物的首过效应,能在给药后迅速吸收、起效快。(3)剂型独特,增加卒中治疗方式的灵活性,提高用药依从性,相对于注射液更加安全、可及、便捷, 适用于卒中患者发病后及时给药和院外给药,可与先必新组成序贯疗法利于患者获得及时和完整疗程,让卒中救治能够更早一步、疗程更足。

2.3.2. Y-2舌下片市场规模预测,2030年峰值销售额有望达到29.6亿
- 上市及纳入医保时间假设: Y-2舌下片治疗急性缺血性卒中的中国Ⅲ期注册临床研究已于2022年12月1日宣布III期临床达预期疗效终点,预计于2023年H1申报NDA。目前进入随访及数据统计阶段。公司预计2023年H1递交上市申请,我们假设Y-2舌下片2024年获批上市,并于当年医保谈判成功,顺利进入医保目录。
- 潜在患者人数假设: 据公司相关报道,Y-2舌下片主要市场人群为使用过先必新注射液的卒中患者,采用出院带药和居家常备的销售策略,根据之前先必新注射液的市场规模预测,2024年先必新注射液用药人数约为170万人,随后逐年上升。此外,先前不使用先必新注射液的卒中患者也作为市场潜在人群,2024年此部分患者人数约为734万人,随后逐年递增,2030年预计将达1126万人。
- 渗透率假设: 得益于先必新注射液积累的临床认可度与医患人群,我们假设2024上市首年,Y-2舌下片在先必新注射液用药患者中的渗透率为20%;随着舌下片纳入医保后市场进一步下沉以及实际疗效得到医患的充分认可,我们假设之后在使用先必新注射液患者中的渗透率迅速提升,2028年即可达到峰值约60%;此后至2030年渗透率基本维持不变。针对未使用过先必新注射液的患者,初始渗透率假设为1%,随后逐年小幅提高至10%。
- 药物价格假设: 先必新注射液定价为每盒420元/6支,含有60mg依达拉奉及15mg右莰醇,Y-2舌下片每片含依达拉奉30mg及右莰醇6mg,我们假设Y-2舌下片价格为210元/片,补充院内注射剂给药每疗程2100元,单次即时用药费用为420元。2024年参加医保谈判后,我们假设降幅为15%,随后几年,Y-2舌下片每两年降价一次,每次降幅约10%。
销售峰值预测:基于上述进行销售测算,我们预计Y-2舌下片将在2030年达到销售额29.6亿元。
销售峰值预测:基于上述进行销售测算,我们预计Y-2舌下片将在2030年达到销售额29.6亿元。

2.4. SIM408:布局阿尔茨海默症领域,Aβ靶点全球领先口服小分子药物
2021年6月公司与Vivoryon Therapeutics达成合作,引进两款治疗阿尔兹海默症的在研新药SIM408(Varoglutamstat)和PBD-C06。SIM408是一种谷氨酰肽环转移酶(QPCT)的口服小分子抑制剂。该酶可催化一种具有神经毒性的分子N3pE淀粉样蛋白生成,这种蛋白不仅与AD患者中广泛观察到的聚合成斑块的β淀粉样多肽有关,也会对阿尔茨海默病(AD)的其他病理因素产生不良影响,包括tau病理表现、神经炎症和突触功能受损。
SIM408与礼来的Donanemab和Biogen的Aducanumab靶点一致,均作用于N3pE-Aβ,阻止这种有毒变体的形成。但SIM408在疾病发病机制的早期发挥作用,因此具有预防神经元损伤的潜力。

目前合作方在治疗早期阿尔兹海默症的全球临床研发已进行到临床II期,在欧洲和美国分别进入IIb 期(VIVIAD研究)和IIa/b期(VIVA-MIND研究)。2021年12月20日,FDA已授予该候选药物快速通道(Fast Track)」资格认定。2022年2月24日,SIM0408(盐酸PQ912片)已获得NMPA签发的药物临床试验批准通知书,拟用于阿尔茨海默病(AD)导致的轻度认知障碍(MCI)或轻度痴呆的治疗,并支持于中国开展I期和II期临床试验。
2.5. Daridorexant:布局抗失眠领域,创新的双食欲素受体拮抗剂
2022年11月16日,先声药业与Idorsia公司就新型抗失眠药物QUVIVIQ(daridorexant)在中国的开发签订独家许可协议。daridorexant是一款双重食欲素受体拮抗剂,已经于2022年5月获美国FDA批准上市,并在德国、意大利等国家商业化。先声药业将获得在中国大陆、香港和澳门地区开发和商业化daridorexant的独家权利。
2.5.1. Daridorexant机制创新,疗效及安全性俱佳
唤醒和睡眠信号由大脑中复杂的神经回路调节,这个过程的一个关键组成部分是食欲素系统,它有助于促进清醒。食欲素(orexin)是一种多肽,通过受体OX1R和OX2R促进清醒。食欲素系统刺激唤醒系统中的目标神经元,导致释放几种促进清醒的化学物质(多巴胺、血清素、组胺、乙酰胆碱、去甲肾上腺素)。在正常情况下,食欲素水平在白天随着清醒度的提高而升高,然后在夜间下降,过度活跃的唤醒系统是失眠的一个重要驱动力。

与安慰剂相比,Daridorexant的推荐剂量在IDSIQ(IDSIQ是根据FDA指南专门开发和验证的患者报告结果工具,用于测量失眠患者的日间功能)的日间嗜睡方面显示出高度统计显著的改善,这意味着患者报告在第1个月和第3个月感觉精神和身体上的疲劳更少,睡眠更少,白天更有精力。在临床试验中,最常见的不良反应是头痛和嗜睡,不良反应以轻至中度为主,未观察到不良反应的频率或严重程度与剂量有关的证据,老年患者不良反应情况与年轻患者一致。上市许可还得到了一项长期随访扩展研究的支持,该研究与关键试验一起,提供了长达12个月的连续治疗的临床有效性及安全性的数据。

2.5.2. 失眠药赛道市场空间大,目前竞争相对缓和
睡眠经济规模庞大,且总量稳步增长。根据Datamonitor数据库显示,2019年全球失眠患者人数约为14亿人,其中亚洲患者为6.9亿人。另外,据中国睡眠研究会数据显示,中国成年人失眠发生率高达38.2%,超3亿中国人有睡眠障碍,患者人群相当庞大。根据医药经济报统计数据显示,2021年我国样本医院催眠/镇静药销售额接近20亿元,全国公立医院购药金额为50亿元。过去5年数据显示,2017-2019年的年销售额均呈两位数的增长。

镇静催眠药共历经三代更迭,市场竞争格局相对缓和:第一代的镇静催眠药主要为巴比妥类药物,但由于疗效不佳、副作用大,已被淘汰;第二代的镇静催眠药主要是苯二氮卓类,其长期使用仍会产生反跳性失眠、遗忘、药物依赖等不良反应;第三代的镇静催眠药是非苯二氮卓类,主要为唑吡坦、佐匹克隆等,进一步改善了第二代存在的缺陷,降低了反跳性失眠发生的概率。苯二氮卓受体激动剂(BzRAs)通过作用于GABA能神经元的α受体,进而广泛镇静大脑,但由于药物在体内存留浓度较高而往往会导致头晕、困倦、疲乏和定向障碍等症状,使患者出现宿醉感,并存在多种安全性问题。当前国内失眠药获批上市较少,市场存在较大的临床未满足需求。
新一代的安眠药食欲素受体拮抗剂备受市场关注。新药Daridorexant通过阻断两种食欲素受体,来抑制失眠症患者中过度活跃的觉醒通路,进而发挥助眠作用,作用机制更加清晰明确。与此同时,该药物具有良好的药代动力学特征,约80%的药物成分经夜间睡眠后被机体清除,可最大限度地减少残留效应。Daridorexant有望为入睡困难和睡眠维持困难的成年失眠患者提供全新有效的治疗方案。目前全球已获批上市的食欲素受体拮抗剂,包括苏沃雷生(suvorexant)、Dayvigo(lemborexant),Daridorexant为全球第三。

2.5.3. Daridorexant国内市场规模预测,预计2030年有望实现13.4亿销售额
- 上市时间假设: Daridorexant已于2022年获得FDA批准上市,目前已在德国、美国、意大利等国上市,其疗效及安全性得到充分验证。参考曲拉西利上市历程,结合海南博鳌乐城国际医疗旅游先行区真实世界研究数据及境外上市审评数据,预计可在两年内实现上市,我们预计Daridorexant在2025年实现商业化。
- 潜在患者人数假设: 慢性失眠在成人中的患病率可以达到10%左右(慢性失眠指患者失眠的症状持续3个月以上,并且发生失眠至少3次/周),我们假设这部分患者群体需要在医生指导下使用药物控制,慢性失眠患者假设有20%的比例到医院就诊。随着现代社会节奏和压力的不断提高,睡眠疾病问题日益突出,慢性失眠患病率及就诊率预计缓慢增长。
- 渗透率假设: 针对失眠领域,目前的可用药物主要是苯二氮卓受体激动剂、褪黑素和中成药,Daridorexant上市初可能遇到较大的销售阻力,假设渗透率较低仅为0.5%,但随着医生教育、患者教育、品牌力提升以及先声强大的商业化能力,其市场空间有望逐步打开,预计2030年可实现7%的渗透率。
- 药物价格及用药剂量假设: 卫材的同靶点药物Dayvigo(lemborexant)已在国内上市,价格约为1500元/盒(5mg:100片), 其推荐剂量是10mg/日,最大剂量是20mg/日,假设平均用药剂量是15mg/日;Daridorexant临床试验至少使用90天,假设Dayvigo实际生活中平均用药时长60天,则Dayvigo每疗程价格为2700元/1.8盒,考虑到竞争,我们假设Daridorexant的单疗程使用费用约为2500元。
销售峰值预测:基于上述进行销售测算,我们保守预计Daridorexant将在2030年达到销售额13.4亿元。
销售峰值预测:基于上述进行销售测算,我们保守预计Daridorexant将在2030年达到销售额13.4亿元。

3. 自身免疫领域:重点布局类风湿关节炎,积极探索高潜力市场
先声药业在自身免疫领域布局策略。(1)深度布局 类风湿关节炎(RA)治疗组合,包括英太青(双氯芬酸钠,非甾体抗炎药)、恩瑞舒(阿巴西普注射液,生物抗风湿药物)、艾得辛(艾拉莫德片,传统合成抗风湿药物)、艾捷维(枸橼酸托法替布片,靶向合成抗风湿药),通过产品间组合应用深化RA临床治疗;(2)积极拓展现有产品在尚未受到充分关注的高潜力新适应症市场的应用,开展艾得辛 在干燥综合征领域临床II期实验;(3)拓展其他患者数量大、需求高的自身免疫病产品布局,针对狼疮性肾炎、银屑病、痛风伴高尿酸血症、系统性红斑狼疮进行产品布局和产品研发,申请并展开临床实验。
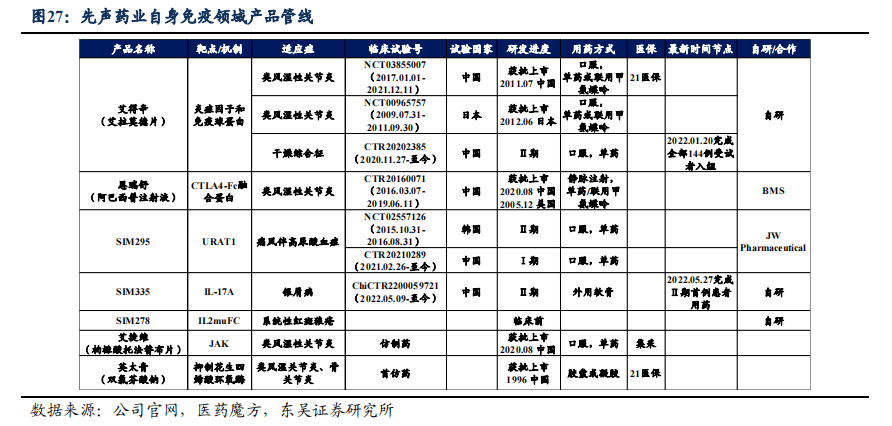
3.1. 艾得辛:传统抗风湿药物,积极拓展干燥综合征
3.1.1. 国内类风湿性关节炎流行及治疗现状
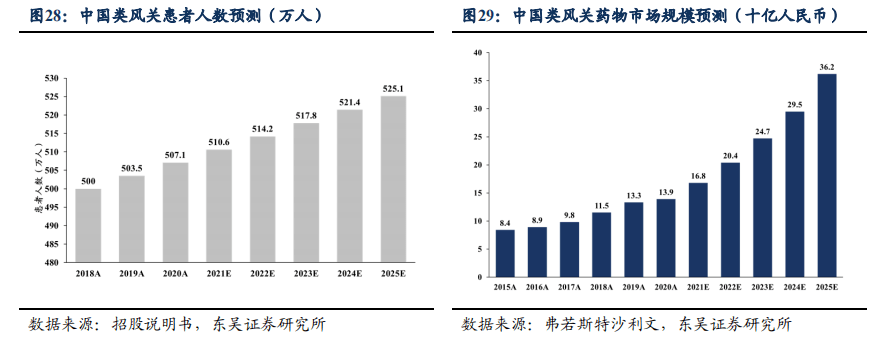
在中国,类风湿关节炎的患病人数已按年复合增长率0.7%由2018年500万例增至2020年507万例,预期2025年患者人数将增至525万例。同时,中国类风湿关节炎药物的销售收入由2015年的84亿元快速增加至2020年的139亿元,预期预计2025年将增加至362亿元,2020-2025年复合年增长率为21.1%。
目前类风湿关节炎主要治疗药物包括非甾体类抗炎药物(NSAIDs)、 改善病情的抗风湿药物(DMARDs)、糖皮质激素、植物药物等。抗风湿药物又分为传统合成抗风湿药物(csDMARDs)、生物制剂抗风湿药物(bDMARDs)和靶向合成抗风湿药物(tsDMARDs)。

3.1.2. 艾得辛治疗类风湿关节炎的临床疗效:显著优于一线用药甲氨蝶呤
- 治疗52周时,艾得辛单药和艾得辛联合甲氨蝶呤的ACR20(美国风湿病学会20%改善标准)应答率分别为77.44%(230/297,P=0.0019)和77.05%(235/305,P=0.0028),均显著优于MTX单药治疗65.87%(193/293)。
三组的各项安全性指标无显著差异,导致治疗中断的药物不良反应(ADR)发生率在艾得辛单药、艾得辛联合甲氨蝶呤和甲氨蝶呤单药组分别为11.45%、8.53%和9.21%。
三组的各项安全性指标无显著差异,导致治疗中断的药物不良反应(ADR)发生率在艾得辛单药、艾得辛联合甲氨蝶呤和甲氨蝶呤单药组分别为11.45%、8.53%和9.21%。

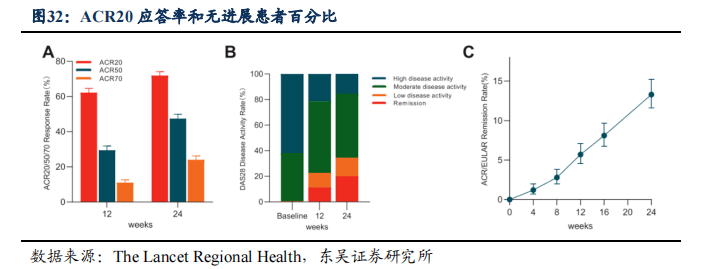
2021年5月,《柳叶刀-区域健康》在线发表艾得辛真实世界Ⅳ期临床研究结果,研究选取了1759例符合美国风湿病学会(ACR)诊断标准的RA患者,在前12周采用艾得辛25mg/bid单药或者加入基础治疗方案,后12周RA治疗方案做适当调整。研究结果显示:
- 使用艾得辛治疗24周,有71.9%(1148/1597)的患者达到了ACR20的主要终点,47.4%(757/1597)和24.0%(384/1597)的患者达到了ACR50和ACR70的次要终点。
- 安全性方面,需要临床格外关注的严重不良事件(SAE≥3级)的发生率为3.4%,0.7%(13/1751)的SAE与艾得辛相关。
分层分析结果表明,病程较短(<2年)、男性患者对艾得辛的治疗反应更佳;而老年患者(≥65岁)和年轻患者(<65岁)达到ACR20/50/70的比例无显著差异,提示艾得辛在老年患者中的疗效与年轻患者一致。
分层分析结果表明,病程较短(<2年)、男性患者对艾得辛的治疗反应更佳;而老年患者(≥65岁)和年轻患者(<65岁)达到ACR20/50/70的比例无显著差异,提示艾得辛在老年患者中的疗效与年轻患者一致。
艾得辛通过大量临床实践与证据赢得了临床学术界广泛认可,进入国内外多个权威学术指南与路径。2018年被纳入中华医学会风湿病学分会《中国类风湿关节炎诊疗指南》后,又进入了2021新版《中国类风湿关节炎诊疗规范(2021)》。
3.1.3. 艾得辛积极拓展干燥综合征新领域
目前,艾得辛治疗原发性干燥综合征(pSS)的有效性、安全性和最佳剂量的随机、双盲、平行分组、安慰剂对照的Ⅱ期临床试验已于2022年1月20日完成所有144例受试者入组,进入随访期,有望推动艾得辛成为全球第一个将原发性干燥综合征写入说明书适应症的药物。按计划,此Ⅱ期临床试验将继续经过12周的用药及后续随访,于2022年第三季度进入研究数据的统计分析阶段,观察不同剂量下艾得辛对于pSS的治疗效果,并启动后续的Ⅲ期临床试验。

目前全球尚没有药物获批pSS适应症。国内pSS适应症竞争格局中,进度最快的药物处于临床II期,分别是先声药业的艾得辛和荣昌生物的泰它西普,但艾得辛的总用药金额(约0.2万元)远远低于泰它西普(约4万元)。艾得辛在pSS适应症上的研发进度处于第一梯队,目前临床证据充分,有望在今年启动三期临床试验,未来快速切入市场。
3.1.4. 艾得辛市场规模预测,2030年峰值销售额有望超13.1亿
- 干燥综合征上市时间假设: 艾得辛治疗原发性干燥综合征(pSS)的Ⅱ期临床试验于2022年1月20日完成所有144例受试者入组,目前已进入随访期,公司预计2022年完成II期试验,并启动III期临床研究,有望2024年获批上市。2020年4月,艾得辛被纳入《原发性干燥综合征诊疗规范》,上市概率大。
- 潜在患者人数假设: 2020年中国类风湿关节炎的患病人数约586万人,2021-2030年CAGR为0.7%,预计2030年将达628万人。2021年中国干燥综合征患者约62.9万人,预计到2025年将达到64.1万人,2030年将达到64.4万人。
- 渗透率假设: 针对类风湿关节炎适应症,2020年渗透率为2.9%,2021年下滑至2.1%,公司预计2022年将有恢复性增长,我们假设渗透率为2.5%,之后保持10%的增速平稳增长至2030年。针对干燥综合征适应症初始渗透率假设为2.5%,随着艾得辛的临床疗效与价格优势逐渐得到患者和医生的认可,我们假设之后渗透率保持翻倍增长,至2029年为20%。
- 药物价格假设: 艾得辛是中国唯一获批治疗类风湿关节炎的艾拉莫德药物,自2017年2月进入医保至今,并未降价,平均周治疗费用约194元,按照24周为一个完整疗程治疗,用药总金额约为4656元;2022年底将进行医保续约谈判,我们假设价格或存在小幅度下降约2%。干燥综合征患者按照12周为一个完整周期治疗,上市首年用药总金额为2282元。我们假设2024年参加医保谈判纳入干燥综合征适应症,降幅10%,随后几年,艾得辛每两年降价一次,每次降幅约10%。
- 用药时长与剂量假设: 针对类风湿关节炎适应症,真实世界药物用量为每日2次,每次25 mg口服,平均24周为一个完整疗程。针对干燥综合征适应症,临床阶段用量为25 mg口服,每日2次,治疗12周为一个完整疗程,进入真实世界后,我们假设艾得辛的用量与临床阶段一致。
销售峰值预测:基于上述进行销售测算,我们预计艾得辛将在2030年达到销售额13.1亿元。
销售峰值预测:基于上述进行销售测算,我们预计艾得辛将在2030年达到销售额13.1亿元。

3.2. 恩瑞舒:生物制剂抗风湿药物,疗效与安全性更优
恩瑞舒(阿巴西普注射液)是公司与BMS共同研发,2005年美国FDA批准用于治疗类风湿关节炎,2020年8月在国内正式上市,是中国首个及唯一获批准销售的CTLA4-Fc融合蛋白,也是全球自身免疫病领域第一个、目前唯一一种T细胞选择性共刺激免疫调节剂。阿巴西普是生物制剂抗风湿药物,可与传统合成抗风湿药物(如甲氨蝶呤)联用,用于治疗传统合成抗风湿药物疗效不佳的中重度活动性类风湿关节炎。
3.2.1. 恩瑞舒疗效优于传统合成抗风湿药物,留存率优于其他生物制剂抗风湿药物
恩瑞舒(阿巴西普)有明显优于传统合成抗风湿药的治疗效果。在日本开展的ORIGAMI研究中纳入了325例对传统合成改善病情抗风湿药应答不足、既往未接受过生物制剂治疗的RA患者,并与另外一项日本同期开展的研究中纳入的仅接受传统合成抗风湿药治疗的RA患者通过倾向评分匹配的方法加以比较。 实验结果显示阿巴西普作为一线生物制剂治疗RA的真实临床应用中,患者的疾病活动度、躯体功能和生活质量在治疗后第4周即可取得显著改善,且持续至52周(试验期间),改善明显优于持续传统合成抗风湿药治疗。
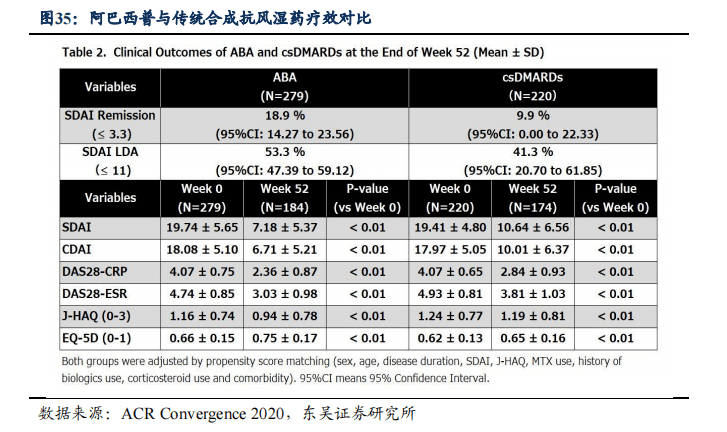
阿巴西普相较于其他生物制剂抗风湿药物在患者体内显示出更好的留存率。根据韩国健康保险审查和评估(HIRA)服务的健康保险索赔数据显示,在2684例患者经过12周治疗后,相较于其他生物制剂抗风湿药物,阿巴西普显示出更高的留存率(69.3%),有更好的持续治疗效果。同时,阿巴西普对抗瓜氨酸蛋白抗体(ACPA)阳性患者显示出更好的治疗效果。在治疗52周后,ACPA阳性的患者体内阿巴西普留存率(89.0%)显著高于ACPA阴性的患者体内阿巴西普留存率(73.8%)。

3.2.2. 恩瑞舒作为生物制剂抗风湿药物未来潜力较大,但市场竞争激烈
生物制剂抗风湿药物作为用于治疗自身免疫病的生物药物的一部分,其在中国的销售收入由2015年的12亿元人民币增加至2019年的37亿元人民币,年复合增长率为31.5%,并预计将以45.5%的年复合增长率由2020年的58亿元人民币快速增加至2024年的260亿元人民币,显示出广阔的市场潜力。
国内现有使用生物制剂抗风湿药物患者的比例仅为8.3%,但在欧美发达国家有约70%的类风关患者在使用生物制剂治疗。显著比例差异背后,是巨大的未被满足的临床治疗需求。恩瑞舒针对ACPA(抗环瓜氨酸肽抗体)阳性患者疗效更强,安全性更好,具备一定市场潜力。
恩瑞舒自2005年在美国获批以来销售额稳步提升,2021年全球销售额达到33.06亿美元,但国内生物制剂抗风湿药物市场竞争激烈,阿达木单抗、英夫利西单抗等原研药和生物类似药不胜枚举,恩瑞舒目前价格偏高,如后续能实现医保覆盖,市场份额有望进一步提升。

3.2.3. 恩瑞舒市场规模预测,2030年销售额可达9亿元
- 潜在患者人数假设: 2020年中国类风湿关节炎的患病人数约586万人,2021-2030年CAGR为0.7%,预计2030年将达628万人,其中其中70%为中重度类风关患者。
- 渗透率假设: 由于国内生物制剂抗风湿药物市场竞争激烈,且恩瑞舒没有进入医保,我们假设2023-2025年渗透率保持50%的增速;随着生物制剂抗风湿药物市场接受度不断提高,我们假设2025-2030年渗透率能够继续保持至少50%增速,预计恩瑞舒渗透率到2030年达到0.67%。
- 产品价格假设: 恩瑞舒在中国上市后价格为6320元:125mg(0.95ml)*4支,恩瑞舒治疗中重度类风湿关节炎周期为24周,总治疗费用约7.6万元。随着类风关市场竞争日趋激烈,以及中重度类风湿关节炎市场的逐渐成熟,我们假设2023年以后,恩瑞舒每年降幅5%-15%。
- 用药时长与剂量假设: 体重在60kg以下的成人,一次性静脉滴注500mg,体重在60-100kg成人,一次滴注750mg,体重在100kg以上者可一次滴注1000mg。在首剂后的第2周和第4周再各给药1次,此后每4周给药1次,周期为24周。
销售峰值预测:基于上述进行销售测算,我们预计恩瑞舒销售额能够持续增长,预计将在2030年达到9亿元销售额。
销售峰值预测:基于上述进行销售测算,我们预计恩瑞舒销售额能够持续增长,预计将在2030年达到9亿元销售额。

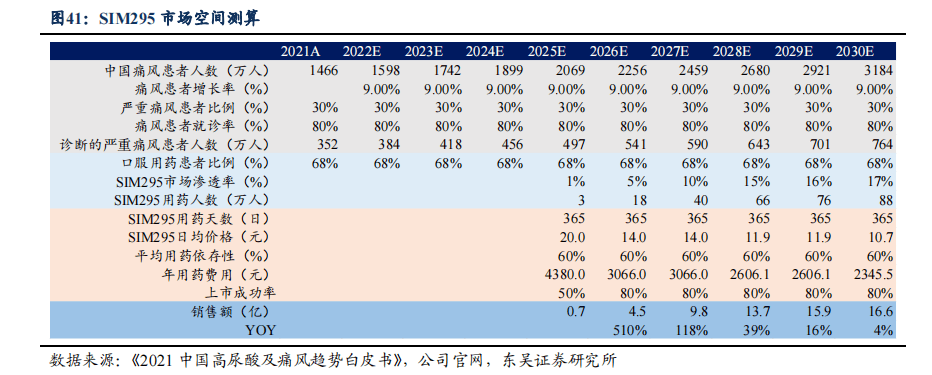
3.3. SIM295:聚焦痛风伴高尿酸血症,研发进度国内第三
SIM295是先声药业2019年引进于JW Pharmaceutical公司的一种选择性抑制尿酸转运蛋白(URAT1)的小分子创新药,用于治疗痛风伴高尿酸血症。痛风是一种常见的代谢性疾病,是单钠尿酸盐(MSU)沉积所致的晶体相关性关节病,与嘌呤代谢紊乱、尿酸排泄减少所致的高尿酸血症直接相关。
URAT1选择性抑制剂是一种新的痛风治疗在研药物,其通过选择性地抑制URAT1对尿酸的重吸收,促进尿酸排泄,从而达到降尿酸效果。 SIM295是对URAT1的高选择抑制剂,排除了对OAT1/3的选择抑制作用 ,可能有助于提高其安全性。临床前数据显示,其相比苯溴马隆降尿酸疗效更显著,且肝肾副作用可能更低。
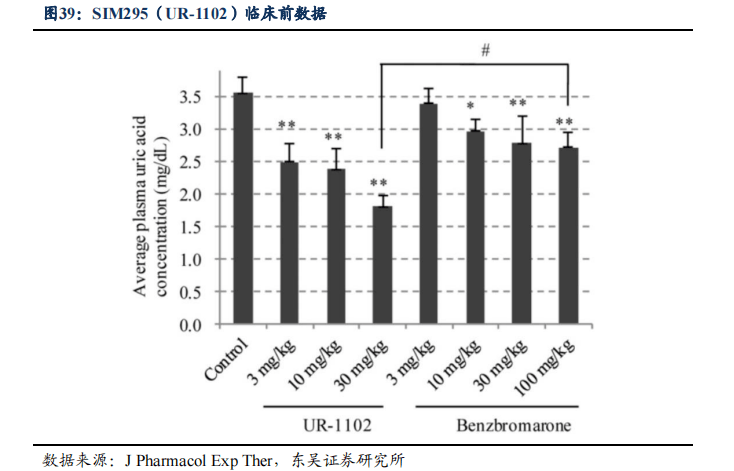
目前已上市降尿酸药物在疗效和安全性上均存在较大的局限性。如苯溴马隆疗效虽好,但存在一定的肝损伤,合并慢性肝病的痛风或高尿酸血症患者必须慎用;非布司他为新一代黄嘌呤氧化酶(XO)抑制剂,2013年进入中国市场,在肾脏安全性上优于别嘌醇,但是临床中表现出增加不良心血管CV事件风险。
SIM295临床进度国内前三,有望在竞争中脱颖而出。目前国内高尿酸血症患者的发病率为10%,约有1.3亿的潜在人群。痛风患病率也呈现上升趋势,患者约在3200万人,已成为中国第二大代谢类疾病。预计到2024年,国内的痛风市场将达到50亿元,而URAT1选择性抑制剂成为近些年的研究热点,目前中国尚无获批销售的URAT1高选择性抑制剂。SIM295在国内众多URAT1高选择性抑制剂的研发中进度排名第三,已在韩国完成Ⅱb期临床试验,公司桥接韩国的Ⅱb期临床试验结果,在国内已经递交Ⅲ期注册性临床试验申请,有望在激烈竞争中脱颖而出。

3.3.1. SIM295市场空间测算,预计2030年可实现16.6亿销售额
- SIM295在国内已经递交Ⅲ期注册性临床试验申请,我们预计2025年递交NDA,2026年可实现商业化。
- 潜在患者人数假设: 《2021中国高尿酸及痛风趋势白皮书》显示,我国高尿酸血症患者人数已达1.77亿,其中痛风患者超过1466万人,每年新发患者增长率约为9%。假设高尿酸痛风患者中需要就诊的严重痛风患者比例为30%,就诊率约为80%。
- 渗透率假设: 根据中康消费者研究中心《2022年中国消费者健康洞察疼痛系列报告_痛风篇》报告,就诊患者中约68%使用口服药物进行治疗。目前现有药物普遍存在安全性问题,急需新型安全有效药物满足临床需求,先声URAT1抑制剂进度处于前三位,竞争格局良好,初始渗透率假设为1%,2026-2030年放量明显,2030年实现17%的市场占比。
- 产品价格假设: 国内主流的 URAT1 抑制剂苯溴马隆目前日治疗费用约为5元,我们假设SIM295上市时日治疗费用为20元,上市第二年进入医保,降价幅度为30%,两年后医保续约再降价15%。
销售峰值预测:基于上述进行销售测算,我们预计恩瑞舒销售额能够持续增长,预计将在2030年达到销售额16.6亿元。
销售峰值预测:基于上述进行销售测算,我们预计恩瑞舒销售额能够持续增长,预计将在2030年达到销售额16.6亿元。
4. 肿瘤领域:专注靶向药物和肿瘤免疫疗法
在肿瘤领域,公司不断强化血管靶向机制,如恩度(重组人血管内皮抑制素)、赛伐珠单抗(注射用VEGF单克隆抗体)等,其次专注于肿瘤免疫治疗,如恩沃利单抗(全球首款上市的皮下注射给药PD-1抗体)、SIM323(CD80/IL2双功能融合蛋白)、SIM237(PD-L1/IL15)、SIM235(人源化抗TNFR2单克隆抗体)等,以及持续钻研肿瘤驱动基因异常和合成致死机制,如SIM201(新一代NTRK多激酶小分子抑制剂)、SIM270(新一代口服选择性雌激素受体降解剂)等,最后拓展肿瘤支持治疗,旨在改善患者QoL和生存时间,如曲拉西利(CDK4/6小分子抑制剂)。

4.1. 恩度:重组人血管内皮抑制素,拓展恶性胸腹腔积液新适应症
4.1.1. VEGF:诱导血管生成,为肿瘤提供养分
血管内皮生长因子(VEGF)指可以促进血管内皮细胞通透性一类物质。VEGF功能主要是促进血管内皮细胞增殖,血管形成以及血管通透性增加等作用,还包括免疫调节、神经保护、组织修复等多种功能。VEGF主要通过和其受体结合,调节肿瘤的血管生成,从而激活细胞内信号通路。
目前抗血管生成药物主要包括小分子多靶点血管生成抑制剂、大分子单靶点血管生成抑制剂、抗血管生成融合蛋白和内源性泛靶点血管生成抑制剂四类。
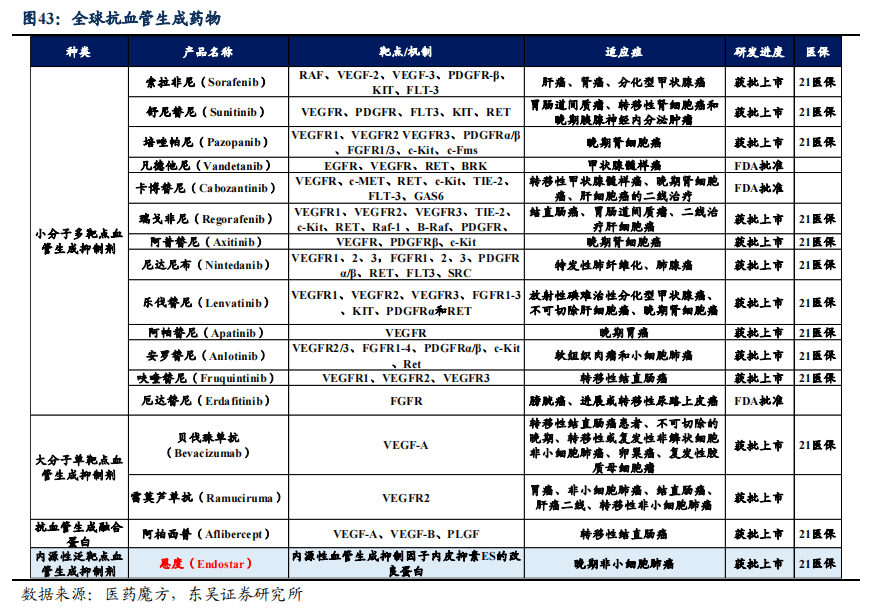
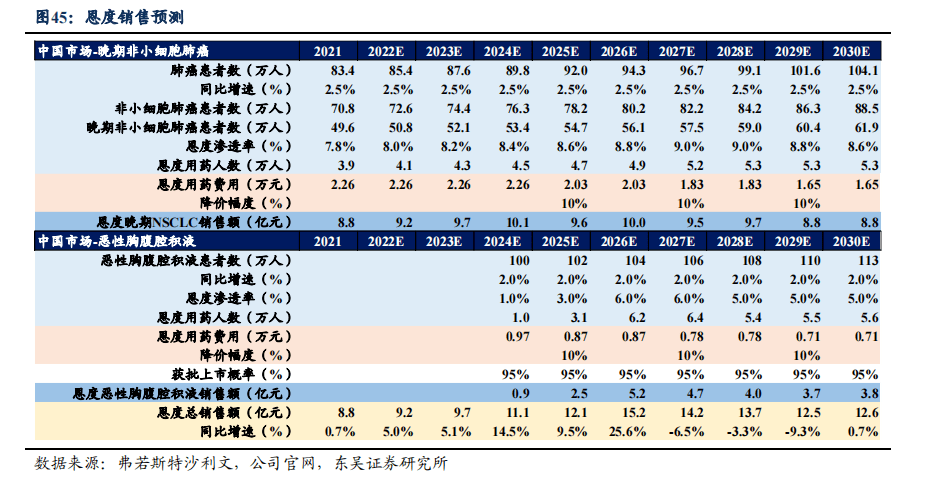
恩度(重组人血管内皮抑制素)为公司一类创新生物药,为中国第一个抗血管生成靶向药,国内外唯一获准销售的内皮抑制素,首个中国获批的非小细胞肺癌一线治疗生物创新药。恩度2005年9月获批上市,联合长春瑞滨/顺铂用于治疗晚期非小细胞肺癌(NSCLC),于2017年通过国家医保大病谈判被纳入国家医保药品目录,并于2019年续约成功。恩度目前正在积极拓展恶性胸腹腔积液新适应症,目前腔内应用恩度和/或顺铂治疗恶性胸腹腔积液的前瞻性、随机对照、全国多中心Ⅲ期临床研究正在推进。
4.1.2. 恩度联用治疗前景广阔,用于恶性胸腹腔积液新适应症临床疗效显著
针对恶性胸腹腔积液适应症,恩度联用顺铂治疗恶性胸腹腔积液的临床试验已经到III期。 除恩度外,国内没有治疗恶性胸腹腔积液的管线进入临床。2020年9月纳入《重组人血管内皮抑制素治疗恶性浆膜腔积液临床应用专家共识》,新适应症获批概率大,或将带来新的销售增长。
浆膜腔积液(包括胸腔、腹腔和心包腔积液)是恶性肿瘤的常见并发症,明显影响患者的抗肿瘤治疗、生活质量和生存时间。部分癌种,如腹膜癌、肺癌、卵巢癌、肝癌等,发展至晚期出现恶性胸腹水的风险非常高,甚至可以达到60%以上。流行病学数据显示,在美国,有60万患者伴有该并发症,在中国,保守估计有近100万浆膜腔积液患者。

4.1.3. 恩度市场规模预测,2026年销售额可达15.2亿元
- 新适应症上市时间假设: 恩度联用顺铂治疗恶性胸腹腔积液已推进至III期临床阶段,公司预计2022年中完成全部受试者招募,2024年新适应症获批上市。由于恩度治疗恶性浆膜腔积液疗效确切,安全性良好,并于2020年9月纳入《重组人血管内皮抑制素治疗恶性浆膜腔积液临床应用专家共识》,因此我们假设新适应症获批概率为95%。
- 潜在患者人数假设: 根据弗若斯特沙利文报告测算:中国肺癌患者人数以每年2.5%的速度增加,预计2030年将达104万人,其中非小细胞肺癌(NSCLC)患者人数约占85%,晚期NSCLC患者占比70%。由于多瘤种晚期伴发胸腹腔积液,我们假设2024年患者人数为100万人,并以每年2%的速度增长。
- 渗透率假设: 由于NSCLC治疗技术迅速发展,众多靶向药物陆续获批,恩度在NSCLC中的份额被逐渐压缩,我们测算2021年渗透率为7.8%,假设至2028年渗透率平稳发展随后逐年下降。目前国内没有治疗恶性胸腹腔积液的新药管线进入临床,初始渗透率假设为1%,我们假设恩度2025-2026年由于医保谈判后放量明显,渗透率分别首年的3倍与6倍,随后逐年放缓。
- 药物价格假设: 2021年恩度第三次医保续约谈判未降价,定价为538元/支,晚期NSCLC患者按照每日一支的治疗频率,全疗程共需接受42针治疗,用药总金额为2.26万元。恶性胸腹腔积液患者按照每周3支,全疗程共需接受18针治疗,上市首年用药总金额为0.97万元。假设2024年参加医保谈判纳入恶性胸腹腔积液适应症,降幅10%,随后几年,恩度每两年降价一次,每次降幅10%。
- 用药时长与剂量假设: 晚期NSCLC患者用量为每天一支,连续给药14天为一个周期,通常进行3个周期的治疗。恶性胸腹腔积液患者临床阶段用量为第1、4、7天每天一支,3次为一个周期,通常进行6个周期的治疗,进入真实世界后,我们假设实际用量与临床阶段一致。
销售峰值预测:基于上述进行销售测算,我们预计恩度将在2026年达到峰值销售额15.2亿元。
销售峰值预测:基于上述进行销售测算,我们预计恩度将在2026年达到峰值销售额15.2亿元。
4.2. 恩维达(恩沃利单抗):首款皮下注射PD-L1
恩沃利单抗(KN035)是康宁杰瑞、思路迪与先声药业合作的全球首款皮下注射的PD-L1抑制剂。其主要适应症包括高度微卫星不稳定性、肉瘤、胆道癌、高度肿瘤突变负荷、微卫星稳定子宫内膜癌等。2021年11月25日,KN035获NMPA附条件批准在中国上市,适应症为 治疗既往接受过氟尿嘧啶、奥沙利铂和伊立替康治疗的微卫星高度不稳定(MSI-H)晚期结直肠癌以及其他既往至少一线标准治疗失败的DNA错配修复功能缺陷(dMMR)晚期实体瘤。

4.2.1. 恩沃利单抗疗效优越,安全性突出,给药方式友好利于在疫情下推广
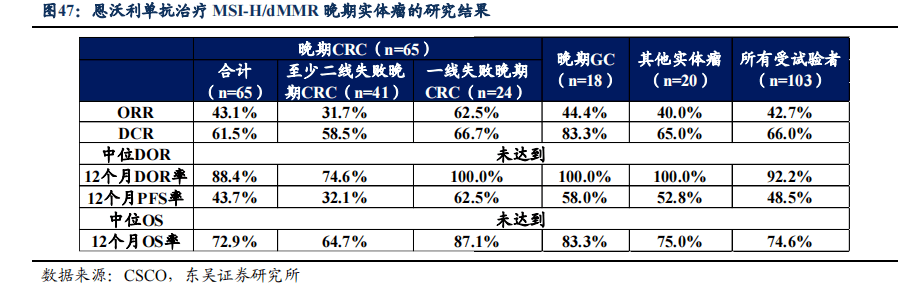
结合竞争格局我们总结了恩沃利单抗的核心优势为:
针对MSI-H/dMMR实体瘤患者,恩沃利单抗疗效与同类产品相当,ORR与mPFS潜在更佳:国内MSI-H/dMMR同适应症竞争中,帕博利珠单抗于2021年6月10日获批,2021年11月25日恩沃利单抗第二个获批上市,百济神州的替雷利珠单抗2022年3月11日获批上市,复宏汉霖的斯鲁利单抗2022年3月24获批上市。翰思生物的普特利单抗已提交上市申请,康方生物的AK104和齐鲁制药的QL1604的MSI-H/dMMR适应症均处于Ⅱ期临床阶段。
针对MSI-H/dMMR实体瘤患者,恩沃利单抗疗效与同类产品相当,ORR与mPFS潜在更佳:国内MSI-H/dMMR同适应症竞争中,帕博利珠单抗于2021年6月10日获批,2021年11月25日恩沃利单抗第二个获批上市,百济神州的替雷利珠单抗2022年3月11日获批上市,复宏汉霖的斯鲁利单抗2022年3月24获批上市。翰思生物的普特利单抗已提交上市申请,康方生物的AK104和齐鲁制药的QL1604的MSI-H/dMMR适应症均处于Ⅱ期临床阶段。

恩沃利单抗具有优越的安全性以及给药时间间隔。在所有免疫相关不良事件中,KN035导致的免疫相关性肺炎、免疫相关性结肠炎的所有级别发生率为所有同类产品中最低,仅为0.5%、0%。与此同时,由于KN035给药方式为皮下注射,因此不存在任何输注反应。此外,KN035药物动力学模拟支持未来给药间隔从一周使用一次(QW)延长到三周使用一次(Q3W)。
恩沃利单抗具有优越的安全性以及给药时间间隔。在所有免疫相关不良事件中,KN035导致的免疫相关性肺炎、免疫相关性结肠炎的所有级别发生率为所有同类产品中最低,仅为0.5%、0%。与此同时,由于KN035给药方式为皮下注射,因此不存在任何输注反应。此外,KN035药物动力学模拟支持未来给药间隔从一周使用一次(QW)延长到三周使用一次(Q3W)。

恩沃利皮下注射的给药方式,便利性,安全性均优于静脉给药:恩沃利单抗给药方式相比于静脉注射更具有优势。(1)给药速度快,可在30秒内完成给药,可以自我注射,大幅节约医患时间与医疗资源;(2)覆盖面更加广阔,皮下注射可以应用于血管通路受限而无法使用静脉制剂的患者人群;(3)皮下注射可以保证相对稳定的血浆药物浓度;(4)室温下稳定,便于患者储存携带。
4.2.2. 恩沃利单抗市场规模预测,2030年销售额可达19.8亿元
- 潜在患者人数假设: 根据弗若斯特沙利文报告测算:中国癌症新发病例数整体呈上升趋势,2021-2030年CAGR为2.2%-2.6%,预计2025年我国癌症新发病例数将达519.6万人;根据各个癌种MSI-H的发生率综合计算(子宫内膜癌、结直肠癌、胃癌等发生率分别为:20%-30%,12%-15%,15%-20%),我们假设MSI-H患者的占比约为10%,随着MSI状态检测技术的成熟,占比逐步提高至20%。众多肿瘤二线患者治疗比例为50%-80%,我们假设癌症平均接受二线治疗的比例为60%,随着二线疗法的成熟,预计接受二线治疗的比例逐年提升。
- 适应症渗透率假设: 恩沃利单抗于2021年11月在国内获批上市,上市30天内即汇集2000例患者,我们假设2022上市后首年MSI-H渗透率为2%,由于2022年进行医保谈判后降价空间较大,因此我们假设2023/2024/2025年MSI-H渗透率分别为7%/12%/15%,随后由于众多竞品上市使其渗透率逐年下降。
- 药物价格假设: 恩沃利单抗200mg/1.0ml/支的定价为5980元,每疗程使用4支,每疗程药费为23920元,目前赠药方案为买4送4,再买8送药至PD(疾病进展),年治疗费用约7.2万元。2022年参加医保谈判后,我们假设降幅为40%,随后几年,恩沃利单抗每两年降价一次,降幅约10%。
销售峰值预测:基于上述进行销售测算,我们预计恩沃利单抗将在2026年达到峰值销售额28亿元,根据合作协议,公司主要获取推广服务收入,约占总收入70%,因此2030年归公司所有收入为19.8亿元。
销售峰值预测:基于上述进行销售测算,我们预计恩沃利单抗将在2026年达到峰值销售额28亿元,根据合作协议,公司主要获取推广服务收入,约占总收入70%,因此2030年归公司所有收入为19.8亿元。

4.3. 曲拉西利(Trilaciclib):全球唯一骨髓保护作用的CDK4/6抑制剂
Trilaciclib是G1 Therapeutics开发的一款“First-in-Class”小分子短效CDK4/6抑制剂,具有全面的骨髓保护作用,为 全球首个及唯一在化疗期间预防性给药以保护骨髓和免疫系统功能的产品。2020年8月,先声药业与G1 Therapeutics订立独家许可协议,以在大中华区进行曲拉西利的开发及商业化。2021年2月,曲拉西利获美国FDA批准上市。在国内已于2022年7月13日获批上市,适应症为: 在接受含铂联合依托泊苷方案或含拓扑替康方案治疗的小细胞肺癌患者中预防性使用,以降低化疗引起的骨髓抑制的发生率。目前mCRC骨髓保护&延长生存期的三期临床、TNBC延长生存期的三期临床正在开展,预计于2025年上市。
4.3.1. 曲拉西利骨髓保护作用机制
与已经上市的CDK4/6抑制剂不同,曲拉西利是短效可逆的CDK4/6抑制剂。在接受化疗前预防性使用曲拉西利,可以将骨髓细胞短暂阻滞在细胞周期的G1期,显著减少化疗药物对骨髓细胞的杀伤,保护骨髓细胞和免疫系统功能,进而提高患者生存质量,以及增加部分患者的化疗周期数,在特定情况下延长患者的总生存期。

癌症治疗中除了极早期患者可以通过手术治愈外,对于绝大数癌症患者一线治疗中都会使用到化疗,包括新辅助化疗、辅助化疗或者晚期的姑息化疗等,此外在一线进展后,化疗及化疗联合疗法涵盖癌症治疗全线程。然而,化疗常引起骨髓抑制的副作用,对患者生活质量和生存长度造成多种影响,化疗诱导的骨髓抑制是患者生活质量和生存长度的绊脚石。补救性的治疗有时并不会立即起效,因此曲拉西利预防骨髓抑制的临床价值则更具有意义。
4.3.2. 曲拉西利在多瘤种上展现优越疗效
科赛拉(注射用曲拉西利)多适应症的临床研究正在全面铺开。mCRC的骨髓保护&延长生存期的Ⅲ期MRCT试验正在开展,预计2023年递交NDA;TNBC的延长生存期的Ⅲ期MRCT试验正在开展,预计2024年NDA;基于ADC和免疫检查点的联合疗法Ⅱ期正在开展,预期可改善患者结局和减少骨髓抑制副作用;更多样化的机制研究预计进入临床阶段,为曲拉西利带来丰富的临床应用场景。

广泛期小细胞肺癌(ES-SCLC)
根据2022 ASCO公布的最新临床数据显示,在ES-SCLC一线治疗的随机对照研究(G1T28-02、G1T28-05)中,患者在接受化疗方案前,随机分配接受曲拉西利或安慰剂治疗。结果显示,曲拉西利组较安慰剂组可显著降低中性粒细胞减少(SN)、贫血(SA)和血小板减少(ST)的发生率。G1T28-03研究显示,ES-SCLC患者在二/三线接受拓扑替康前,使用曲拉西利或安慰剂进行联合治疗,曲拉西利较安慰剂组可显著降低中性粒细胞减少、贫血和血小板减少的发生率。综上,ES-SCLC患者在治疗前给予曲拉西利,可有效防止骨髓抑制。
广泛期小细胞肺癌(ES-SCLC)
根据2022 ASCO公布的最新临床数据显示,在ES-SCLC一线治疗的随机对照研究(G1T28-02、G1T28-05)中,患者在接受化疗方案前,随机分配接受曲拉西利或安慰剂治疗。结果显示,曲拉西利组较安慰剂组可显著降低中性粒细胞减少(SN)、贫血(SA)和血小板减少(ST)的发生率。G1T28-03研究显示,ES-SCLC患者在二/三线接受拓扑替康前,使用曲拉西利或安慰剂进行联合治疗,曲拉西利较安慰剂组可显著降低中性粒细胞减少、贫血和血小板减少的发生率。综上,ES-SCLC患者在治疗前给予曲拉西利,可有效防止骨髓抑制。

2022年4月首次进入《CSCO小细胞肺癌诊疗指南》,作为广泛期小细胞肺癌化疗骨髓抑制支持治疗新增II级推荐,2A类证据。2022年11月曲拉西利乐城真实世界研究(RWS)数据以壁报形式首次公开发表,曲拉西利在接受多种治疗方案的中国ES-SCLC患者中有良好的全面的骨髓保护作用,疗效趋势一致,安全性良好,无新增安全性信号。真实世界诊疗环境下,该研究未经人为干预筛选地纳入正常接受诊疗的患者,因此该数据能够更好地指导曲拉西利上市后在真实医疗环境下的临床用药。
- 三阴性乳腺癌(mTNBC)
2021年6月,用于三阴性乳腺癌的一项III期药物临床试验获批,并加入曲拉西利用于吉西他滨和卡铂治疗三阴性乳腺癌的国际多中心药物III期临床试验(PRESERVE2研究)。2022年1月7日,达成该试验在中国的首例受试者入组。
- 结直肠癌(CRC)
2021年4月,曲拉西利关于转移性结直肠癌(mCRC)新适应症临床试验申请获批,将在接受FOLFOXIRI/贝伐珠单抗治疗的mCRC患者中开展一项比较Trilaciclib与安慰剂的III期临床研究(PRESERVE1研究),临床终点为严重4级中性粒细胞减少症(DSN)的持续时间和期间严重中性粒细胞减少症(SN)的发生率,次要终点包括患者PFS和OS等疗效指标。2022年6月13日,完成在中国的全部患者入组。
4.3.3. 曲拉西利是全球唯一多线化疗的骨髓保护剂,具有先发优势
在众多CDK4/6抑制剂争夺乳腺癌市场时,曲拉西利作为后来者另辟蹊径选择预防ES-SCLC治疗中骨髓抑制适应症,目前ES-SCLC的治疗以化疗为基石,而化疗引起的骨髓抑制(CIM)是限制这类药物足量,按计划治疗的主要毒性反应。目前市场暂时无其他CDK4/6抑制剂跟随此适应症,会在中国取得先发优势,未来主要用于:(1)化疗之前使用,骨髓保护,增加化疗周期;(2)与ADC联用,降低ADC药物血液系统不良反应,有益的OS改善作用。同时曲拉西利还具备更多的潜能,针对三阴性乳腺癌和转移性结直肠癌骨髓抑制适应症均进入Ⅲ期临床阶段。
2021年曲拉西利在海外Q2、Q3和Q4的销售数据分别为250、360和440万美元,海外销售不佳的原因或在于海外合作公司(G1 Therapeutics)商业化经验不足以及美国疫情严重且美国接受化疗患者数远远低于中国,因此中国市场远大于美国,并且中国医生对曲拉西利期望度较高,预计未来销售峰值超25亿元,大有可为。
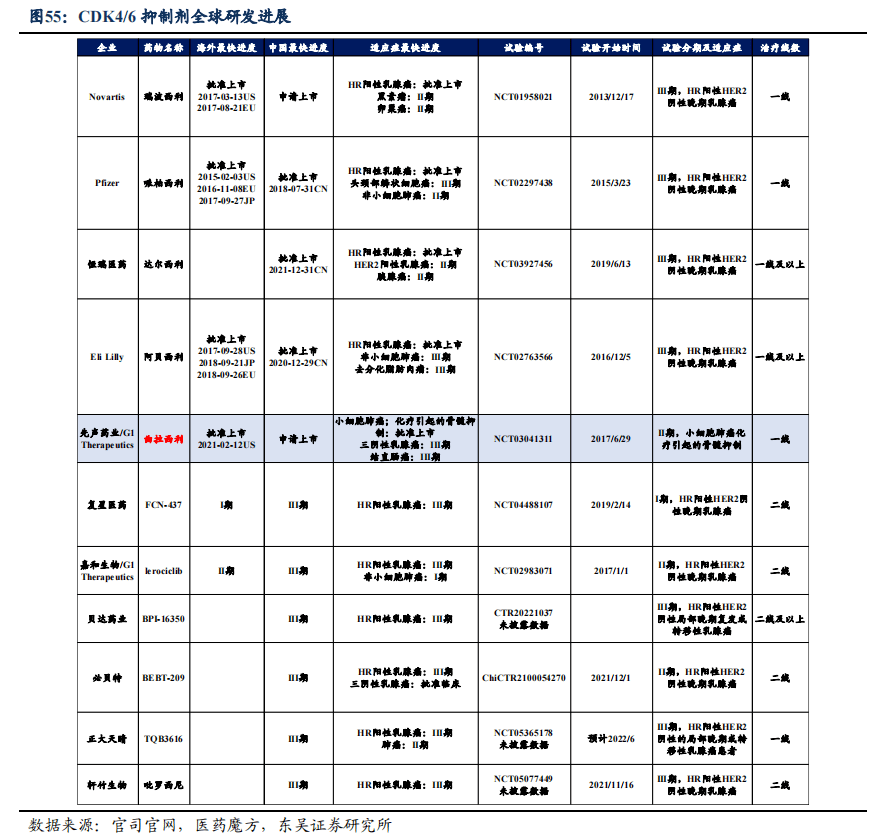
4.3.4. 曲拉西利市场规模预测,2029年销售额可达26.9亿元
- 上市时间假设: 曲拉西利目前国内共有3个核心适应症已获批上市或进入III期临床:小细胞肺癌适应症2022年7月13日获批上市,2022Q4正式商业化;结直肠癌的III期临床试验(PRESERVE1研究)已于2021年9月24日达成在中国的首例患者入组,我们预计2025年上市;三阴性乳腺癌的III期临床试验(PRESERVE2研究)已于2022年1月7日达成在中国的首例患者入组,我们预计2025年上市。由于小细胞肺癌适应症已于美国上市且三阴性乳腺癌适应症获FDA优先审评资格,因此我们假设在国内小细胞肺癌适应症上市概率为100%,结直肠癌及三阴性乳腺癌适应症上市概率为85%和80%。
- 潜在患者人数假设: 根据弗若斯特沙利文报告测算:中国肺癌患者人数以每年2.5%的速度增加,预计2030年将达104万人,其中小细胞肺癌患者人数约占15%。根据IARC发布的2020年全球最新癌症负担数据显示:2020年我国55.4万人新患结直肠癌,2021-2030年CAGR为0.2%。中国乳腺癌患者人数以每年2%的速度增加,预计2030年将达38.7万人,其中三阴性乳腺癌患者人数约占20%。
- 适应症渗透率假设: 小细胞肺癌初始渗透率假设为2%;曲拉西利于2022年进入市场后放量迅速,2023-2024年渗透率10%和15%,之后渗透率达到30%。由于前期铺垫和医保降价后渗透率会有很明显提升,结直肠癌及三阴性乳腺癌适应症获批后进院速度较快,我们假设结直肠癌初始渗透率为6%,三阴性乳腺癌初始渗透率为6%,最终渗透率均为30%。
- 药物价格假设: 曲拉西利价格约为每周期6000元,按照化疗约为5个周期,每个患者每疗程用药总金额为3万元。2023年参加医保谈判后,我们假设降幅为10%,2025参加谈判纳入结直肠癌和三阴性乳腺癌适应症,降幅40%。随后几年,曲拉西利每两年降价一次。
销售峰值预测:基于上述进行销售测算,我们预计曲拉西利将在2029年达到峰值销售额26.9亿元。
销售峰值预测:基于上述进行销售测算,我们预计曲拉西利将在2029年达到峰值销售额26.9亿元。
4.4. 赛伐珠单抗:新一代血管靶向药物,为妇科肿瘤患者提供新选择
由于卵巢癌没有特异性肿瘤标志物,通常患者在确诊时肿瘤已在较晚阶段,因此卵巢癌的预后很差。2020年,我国新发卵巢癌患者5.5万人,5年生存率约为41.8%,年死亡人数超过2万人。卵巢癌公认的标准治疗是细胞减灭手术和术后进行以铂类和紫杉醇为基础的化疗。尽管一线化疗应答率很高,但约70%~75%的患者会复发。

前期临床研究显示,赛伐珠单抗在多个瘤种模型中显示比贝伐珠单抗更强的抑瘤效果。赛伐珠单抗在分子设计上,采用了更高特异性和亲和力的兔抗,可以选择性地与VEGF相结合。体外活性测试结果显示,注射用BD0801对血管内皮细胞生长因子受体2(KDR)磷酸化的抑制能力,以及对人脐静脉内皮细胞(HUVEC)细胞增殖和迁移的抑制活性强于贝伐珠单抗。
赛伐珠单抗的临床应用剂量约为贝伐珠单抗的1/7,潜在安全性和生产成本上具有明显的优势。如能顺利上市,有望在广阔的抗血管生成药物市场占据一定份额。此外,公司旨在与自身管线联动,巩固肿瘤领域的市场,目前赛伐珠单抗联合恩沃利单抗针对晚期实体瘤的研究处于II期临床。
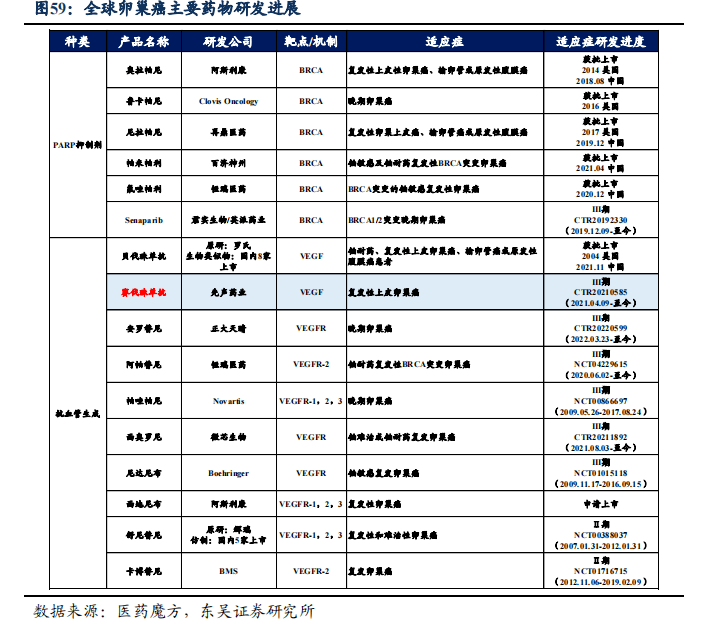
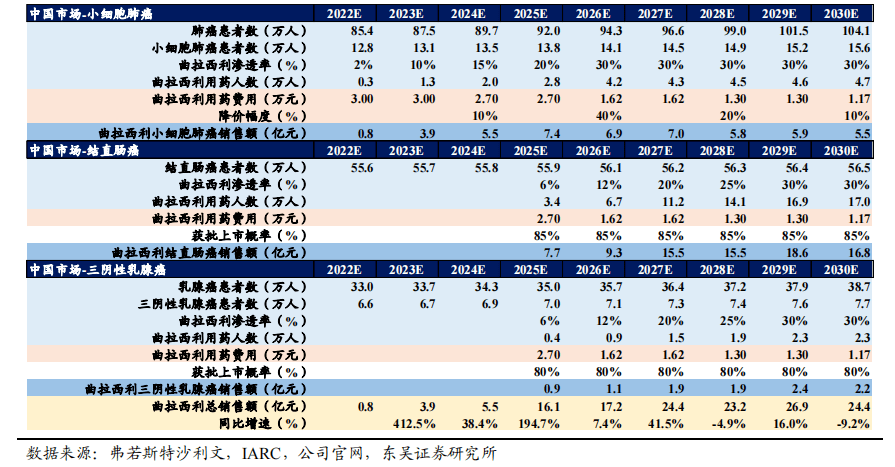
4.4.1. 赛伐珠单抗规模测算,2030年可实现14.2亿销售额
- 上市时间假设:赛伐珠单抗Ⅲ期(SCORES研究)正在进行,预计2023年Q1 进行中期分析,并于2023年 H2递交上市申请,假设2024年实现商业化。
- 潜在患者数量假设:世界卫生组织国际癌症研究机构(IARC)发布的全球癌症负担数据显示,我国2020年卵巢癌新发病例约为5.5万例,年增长率约为3%,预计2030年卵巢癌新发病例约为7.2万例。《2022年中国卵巢癌诊疗现状》显示卵巢癌初始治疗后约70%的患者存在复发,需要靶向治疗药物用于一线治疗后的维持治疗。
- 渗透率假设:基于贝伐珠的临床用药经验,卵巢癌一线化疗后维持治疗的比例约为45%,其中使用抗血管生成药物比例约为35%;卵巢癌二线治疗中抗血管生成药物使用比例为50%。假设塞伐珠2024年上市渗透率为5%,随后快速放量,预计2030年放缓至30%。
- 费用及用药时长假设:贝伐珠用于卵巢癌的用药方案为15mg/Kg Q3W,医保价格为1500元/100mg,一线维持治疗的平均用药时长为15个月,二线平均用药时长为6个月,则一线用药费用为34万,二线用药费用为13.6万。参考贝伐珠用药费用及时长,假设塞伐珠2024年首年上市用药费用一线及二线分别为70万及30万,2025年进入医保后为30万及12万,此后每两年续约谈判降价20%。
销售峰值预测:基于上述进行销售测算,我们预计赛伐珠单抗将在2030年达到峰值销售额14.2亿元。
销售峰值预测:基于上述进行销售测算,我们预计赛伐珠单抗将在2030年达到峰值销售额14.2亿元。

5. SIM417:3CL靶点新冠口服药,成为最快上市产品
SIM417药物是公司与上海药物研究所合作的抗SARS-CoV-2新冠小分子口服药物,主要靶向对新冠病毒的复制增殖起关键作用的3CL蛋白酶(3-chymotrypsin-likeprotease,3CLpro),2022年6月1日完成Ⅰ期临床研究,并于2022年12月19日宣布,其成年感染者的有效性和安全性多中心、随机、双盲、安慰剂对照的II/III期临床研究已完成全部1208例患者入组,2023年1月16日新药上市申请(NDA)获NMPA以药品特别审批程序受理,并于2023年1月29日附条件获批上市,成为国内首个上市的3CL新冠特效药物。
先声药业的SIM417与辉瑞Paxlovid靶点一致,同为3CL新冠口服药物,是国内第一款获批临床的针对新冠病毒开发的口服3CL抑制剂。Paxlovid的真实世界研究让3CL药物在真实世界中的良好疗效和安全性得到全方位验证,也极大增加了先声在SIM417上取得临床研发和商业化成功的概率和信心。
5.1. SIM417研发进展迅速,布局新冠治疗与密接预防双赛道
Ⅱ/Ⅲ期临床研究:SIM0417于中国获得2项药物临床试验批准通知书,分别用于新冠病毒感染人群,以及新冠检测阳性感染者密接人群的暴露后预防治疗。SIM0417针对新冠病毒感染人群的II期临床研究已于2022年6月13日在上海完成首例患者给药,并于2022年12月19日宣布,其成年感染者的有效性和安全性多中心、随机、双盲、安慰剂对照的II/III期临床研究完成全部1208例患者入组。详细数据未来预计在学术期刊或会议上予以公布。
- 加快症状恢复,缩短病程: 在1208例有症状的轻中度COVID-19成年患者中,相较安慰剂,先诺欣®显著缩短11种目标COVID-19症状首次达到持续恢复时间约1.5天,其中重症高风险亚组人群显著缩短约2.4天,同时临床数据提示尽早使用先诺欣®疗效更优。
- 显著的抗病毒效果: 先诺欣®组病毒载量呈现快速、大幅的下降;用药后第5天,病毒载量对比安慰剂最大下降超96%。
核酸转阴时间缩短:先诺欣®组核酸转阴时间较安慰剂组缩短约2.2天。
核酸转阴时间缩短:先诺欣®组核酸转阴时间较安慰剂组缩短约2.2天。

密接暴露后预防研究:2022年5月13日,SIM0417获批临床,拟开展曾暴露于新冠检测阳性感染者的密接人群的暴露后预防治疗,成为国内首个新冠密接预防研究。如能顺利研究成功,社会经济效应将十分明显:一是可以大幅度减轻针对密接人群管理的工作压力,将酒店隔离方式改为居家隔离;二是可以大幅度减轻对密接人群管理所产生的经济压力,包括酒店、转运、医护、停工停产等。
- 辉瑞Paxlovid开展的暴露后预防研究以失败告终: 2022年4月,辉瑞对外公布其口服新冠药Paxlovid用于暴露后预防的II/III期临床(EPIC-PEP)研究情况,该研究共纳入了2957名新冠抗原检测为阴性的成人,在96小时内接触过一个有症状且抗原检测为阳性的个体。结果显示,与安慰剂相比,在接受Paxlovid后5天和10天的成年人中,预防感染的风险分别降低了32%和37%,但未达到统计终点。失败原因或在于:辉瑞Paxlovid研究的入组标准为 密接96小时内纳入, 病毒载量处于下降区间,影响了最终的试验效果。
- 区别于辉瑞,SIM0417的临床设计方案计划 入组密接48小时内的受试者, 提前缩短病毒载量下降时间,从而达到遏制病毒进一步传播的效果。这得益于中国疫情防控措施的高效性,使48小时内的密接者可以很快被发现。
5.2. SIM417获批上市,成为国内3CL靶点首个上市产品
目前,全球已上市&EUA新冠小分子药物共有6款:SIM417、VV116、巴瑞替尼(JAK)、瑞德西韦(RdRp)、Molnupiravir(RdRp)、Paxlovid(3CL)、阿兹夫定,其中Molnupiravir(RdRp)、Paxlovid(3CL)、阿兹夫定、SIM417(3CL)、VV116已在国内获批上市。国产新冠小分子药物研发进入冲刺阶段,靶点多以RdRp和3CL为主,多家药企完成Ⅲ期临床实验的患者入组,其中君实生物近期披露VV116多项Ⅲ期,并于2023年1月29日获批上市,此外靶向3CL的众生药业和前沿生物的产品也进入临床新阶段,但是进度落后于先声药业SIM417。
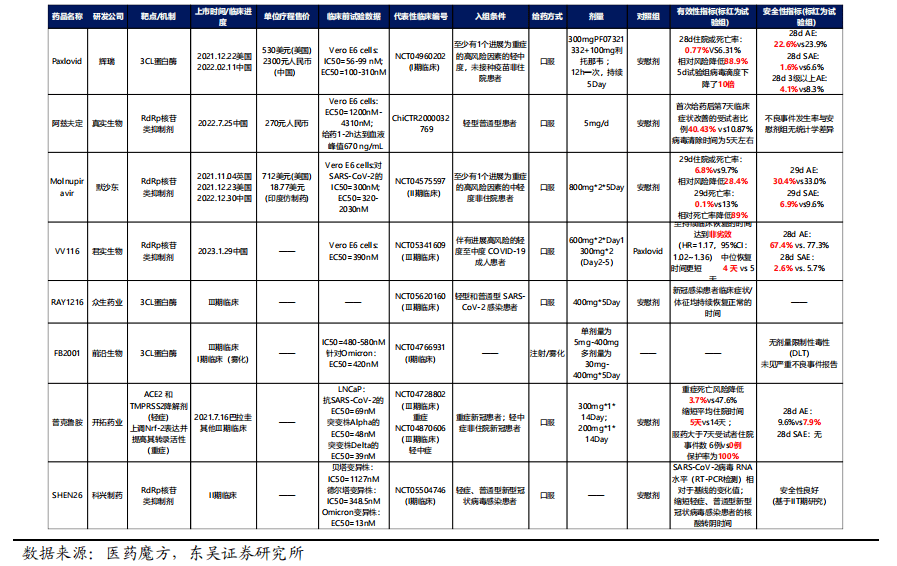
先声药业已经开始计划扩大新冠原料药的产能,对获批上市后商业化潜力充满信心。近日在官网发布的关于“新冠口服药扩建项目环境影响评价公众参与第一次公示”中提及,公司在南京市江北新区生物医药谷华康路99号现有厂区,利用原生产线、厂房设施、公辅工程、改造部分制剂生产设施、环保设施,进行新冠原料药及制剂生产。项目总投资1200万元,项目建成后,预计生产规模为新冠原料药200公斤/年(原料药自产自用),新冠口服药3.2亿片/年。

5.2.1. 新冠特效药市场空间预测
新冠特效药市场空间预测:(1)首年即2023年市场空间预测约560~800亿:人民群众的自我保护和预防重症的意识较强,我们认为新冠药物上市的首年,互联网或者药店平台可能存在大量囤药现象,假设20%~30%的人进行囤药或用药,平均每人一个疗程,预计全国首年囤药/用药约2.8~4.2亿疗程。2023年1月阿兹夫定公布医保谈判价格为175元/疗程,考虑到新冠特效药的创新性和临床价值,我们假设特效药价格为200元/疗程,预测首年的新冠特效药市场空间为560~840亿; (2)未来感染率趋于稳定,市场空间预测每年约70~210亿:首年之后每年药物的消耗根据有症状感染患者的数量趋于稳定,假设全国人民已完全感染,假设每年的重复感染人次约为10~20%,预测每年约1~3亿人次感染,感染人群中约70%有症状,其中约50%选择吃特效药,预计存在约0.35~1.05亿人的用药需求,预测每年存在约70~210亿的市场空间。
先声药业新冠特效药销售预测:我们预计国产特效药的市场占比为先声约20%、君实约20%、众生约20%、辉瑞等进口药约10%、感冒药及中药约20%、10%其他产品。预测先声首年拥有潜在112~168亿收入,之后每年拥有潜在约14~40亿收入。 我们认为SIM0417未来能够为先声带来较为可观的收入,考虑到新冠突变/政策/需求等不确定性,暂不纳入估值预测中,预计能够为先声提供较高的业绩增长空间。
6. 重磅仿制药集采放量,提供有力收入支撑
仿制药布局肿瘤、自身免疫、心血管系统及抗感染等领域。根据医药魔方中国上市药品库显示,先声药业持证的仿制药品种约170个,其中通过一致性评价的品种约有22个(其中15个为国采品种,先声4个中标品种,仑伐替尼第七批集采中标),首仿品种约10个,涵盖超过10个治疗大类,其中在抗肿瘤、抗感染、心血管系统、自身免疫等治疗领域品种较多。
多品种市场有待开拓,集采推动销售放量。从竞争情况看,吗替麦考酚酯口服常释剂型、头孢克洛干混悬剂竞争格局相对良好;从市场格局看,先声药业在硝苯地平缓释控释剂型、吗替麦考酚酯口服常释剂型、甲磺酸仑伐替尼胶囊、头孢克洛干混悬剂等品种的市场正待开拓,有望通过集采中选实现放量。
甲苯磺酸艾多沙班片首仿+首家报产,伊布替尼胶囊首仿独家报产。艾多沙班是第一三共研发的一种选择性Xa因子抑制剂,2020年全球销售额1541亿日元,2021年中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院终端艾多沙班的销售增速高达5527.67%。;伊布替尼是是全球首款获批上市的BTK抑制剂,2021年全球销售额达97.77亿美元。首仿大品种格局相对良好、产品生命周期长、市场容量足够,为销售提供有力支撑。
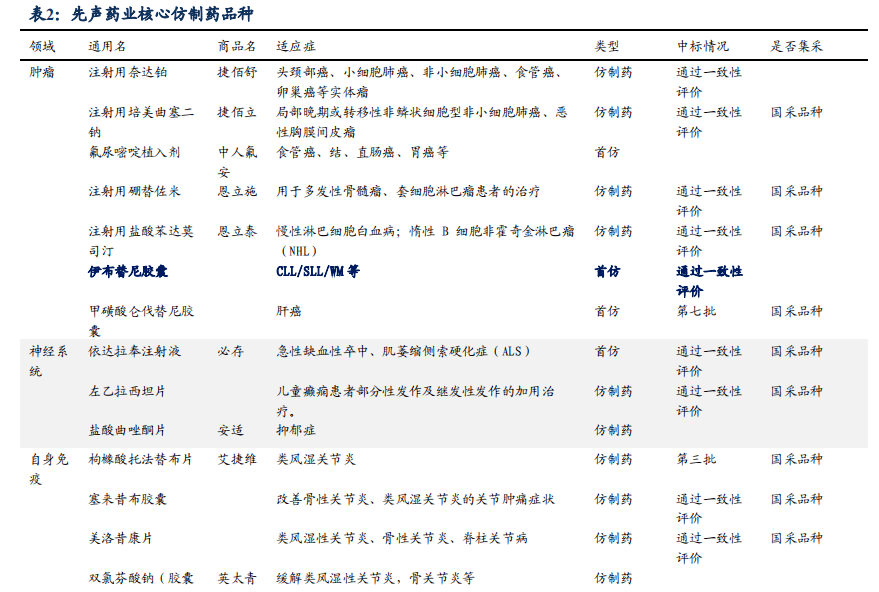
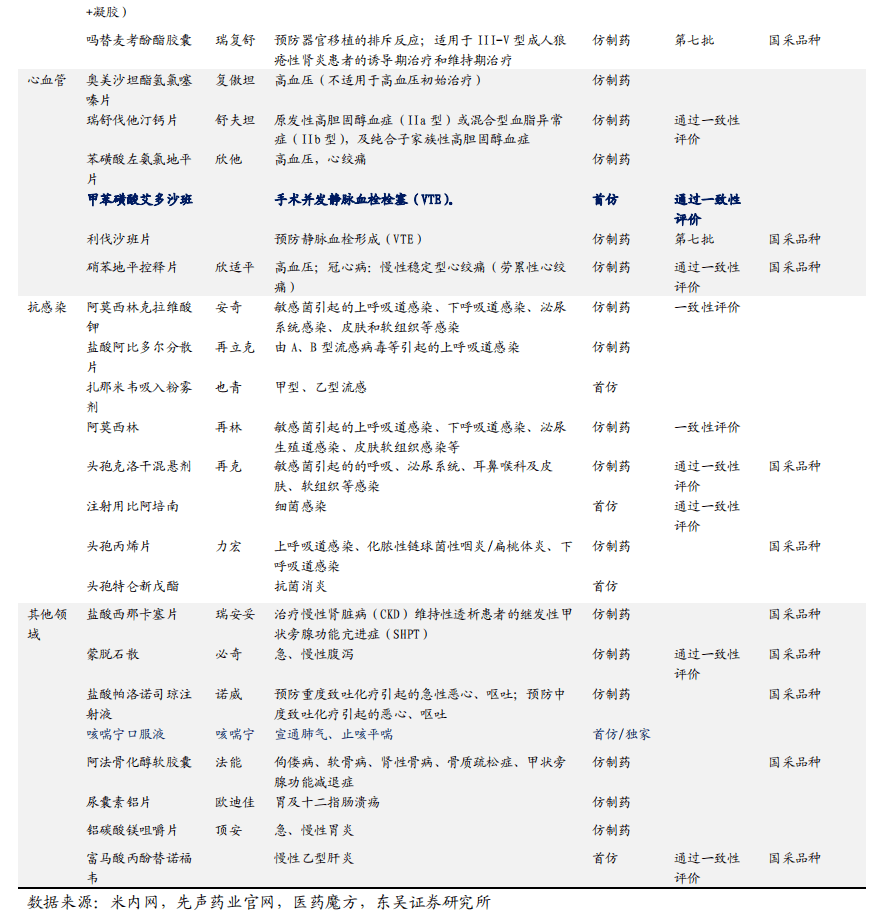
12个重磅仿制药冲线在即,提供有力业绩支撑。哌柏西利适用于HR+/HER2-的局部晚期或转移性乳腺癌,2021年全球销售额达54.37亿美元;阿普米司特片是新基研发的PDE-4小分子抑制剂,用于银屑病治疗,2021年销售额达到22.49亿美元;富马酸贝达喹啉片为强生研发的耐多药肺结核药,2021年医疗终端销售增速超300%,目前仅北京福元医药、海南先声药业两家企业进入BE试验,有望拿下首仿。帕洛诺司琼、巴曲酶、泊沙康唑、伏立康唑、司维拉姆等重磅仿制药市场空间向好,未来有望为先声仿制药业务贡献平稳业绩。

仿制药收入预测,将逐渐企稳回升:随着集采逐渐进入到成熟阶段,对仿制药业务的销售影响逐渐出清,仿制药销售收入将逐渐企稳;2023年OTC端产品疫情受益,主要销售如蒙脱石散、英太青、咳喘宁口服液,预计可带来较高的销售增长;未来随着如艾多沙班、伊布替尼、哌柏西利等多个大平中仿制药上市并纳入集采放量,也将为先声仿制药业务带来持续的增量。我们预计2022-2023年开始保持个位数的增速。

7. 盈利预测与估值评级
7.1. 盈利预测
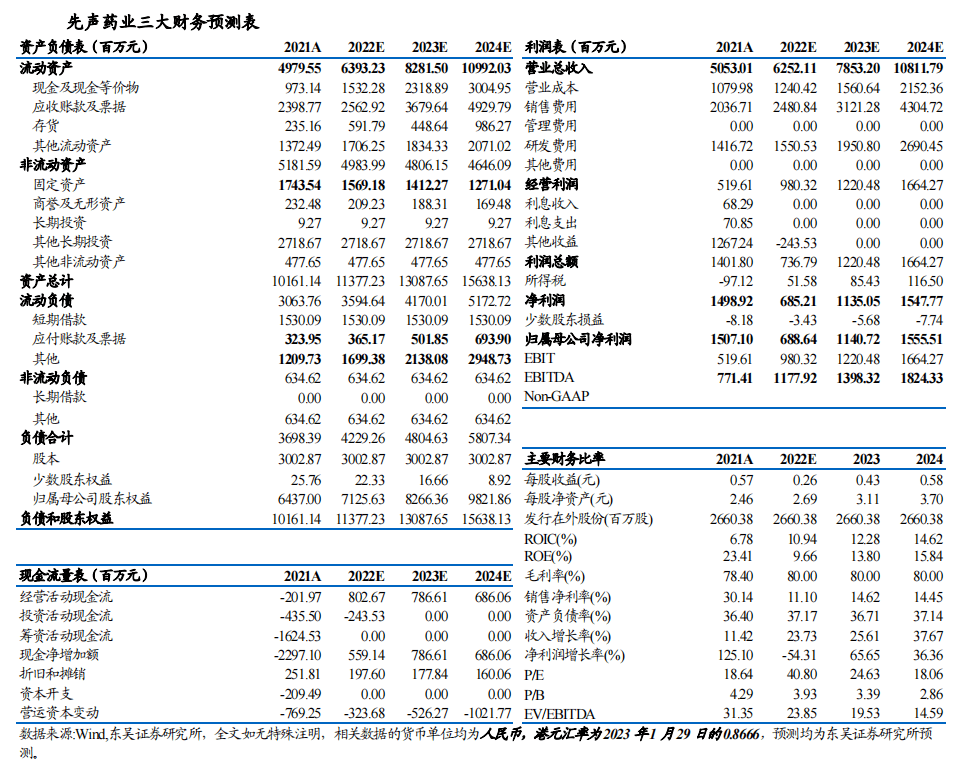
我们预计2022-2024年, 公司产品营业收入分别为62.0亿、78.0亿、107.6亿,增速分别为24.0%、25.8%、37.9%。
中枢神经领域持续高速增长:随着先必新注射液迅速放量及舌下片的获批上市,将为先声带来较高的营收增长。预计2022、2023及2024年中枢神经领域创新药产品销售收入分别为22.2、30.5及47亿元,同比增速为50.1%、37.2%及54.1%。
肿瘤领域产品和适应症丰富:恩维达销售快速增长,曲拉西利2022年7月中国获批。预计2022、2023及2024年肿瘤领域创新药产品销售收入分别为13.2、19.0及29.6亿元,同比增速为37.0%、44.1%及56.0%。
自免领域产品稳定增长:今年产品销售将恢复性增长,未来平稳发展。预计2022、2023及2024年自免领域创新药产品销售收入分别为7.7、8.6及10.1亿元,同比增速为17.3%、12.3%及17.4%。
仿制药收入企稳逐渐回升:随着集采影响出清及重磅仿制品种上市,预计2022、2023及2024年仿制药销售收入分别为14.0亿元、15.0亿元及16亿元。

随着先声三大领域创新药产品的陆续上市,我们预计到2030年公司可实现约223亿元的销售收入。

7.2. 估值评级
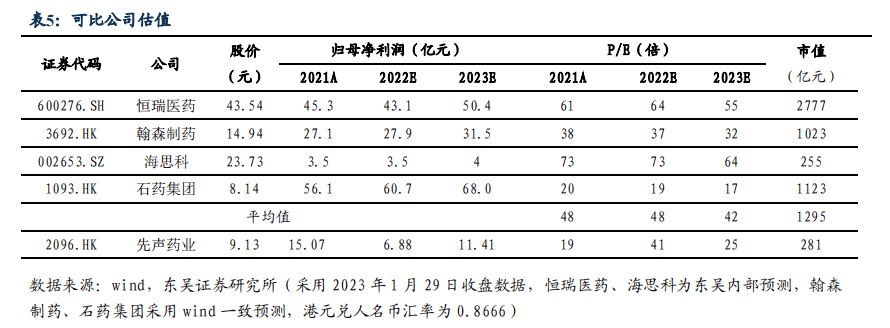
我们采用基于扣非净利润的 PE 估值法计算先声药业的股权价值。不考虑新冠药SIM417的收入,我们预计2022、2023及2024年实现归母净利润分别为6.88亿、11.41亿及15.56亿元,当前市值对应2022-2024年PE为41/25/18倍。由于,1)创新药收入占比持续提升,增长动力强劲;2)业绩增长空间大,保持较高增速;3)仿制药收入逐渐企稳回升。通过对收入结构、管线、销售团队和增长前景的综合考量,我们选取恒瑞医药、翰森制药、海思科、石药集团等国内大型药企作为先声药业的可比公司。首次覆盖给予“买入”评级。
8. 风险提示
新药研发及审批进展不及预期:公司多款创新药及新适应症研发处于临床II/III期阶段,例如艾得辛针对干燥综合征(Ⅱ期)、恩度针对恶性胸腹腔积液(Ⅲ期)、曲拉西利针对结直肠癌/三阴性乳腺癌(Ⅲ期)等。而产品未来收入的增长主要来源于新产品和新适应症的获批,若临床试验或后续结果不及预期,公司将面临收入不及预期等风险。
政策影响对产品价格的不确定性:考虑到医保谈判落地的影响,数量变化可能无法弥补价格降低带来的影响。
核心技术人员、高管流失风险:维持核心技术人员队伍和高管团队的稳定是公司管理和研发的关键,核心技术人员的粘性体现出了公司治理和管理的核心竞争力,考虑到未来创新药企的竞争加剧,基于核心技术人员的抢夺将成为公司未来发展的挑战之一,核心技术人员的流失也将成为公司面临的核心风险之一。
分析师承诺:本报告署名分析师具有中国证券业协会授予的证券投资咨询执业资格并注册为证券分析师,报告所采用的数据均来自合法合规渠道,分析逻辑基于分析师的职业理解,通过合理判断得出结论,独立、客观地出具本报告。分析师承诺不曾因,不因,也将不会因本报告中的具体推荐意见或观点而直接或间接获取任何形式的补偿。
免责声明:
本公众号所载的信息仅面向专业投资机构,仅供在新媒体背景下研究观点的及时交流。
点“在看”给我一个小心心