碱金属和碱土金属单质是比较常用的还原剂,比如锂、钠、钾、镁、钙等。然而,单独使用市售的金属单质可能达不到预期的还原效果。一般的还原实验需要把金属分散成小颗粒,增大反应表面积,进而提高还原效率,例如以锂沙和镁粉分别代替锂棒和镁条。另外一个方法是加入电子转移试剂将电子从金属原子上剥离,比如常用的碱金属/萘体系和K C8 。类似的还有电子盐(electrides,比较典型的例子是金属的液氨溶液)。
由于电负性较低,碱土金属倾向于失去两个电子,形成二价的化合物。然而,科学家们利用合适的配体,可以将相应的二价碱土金属化合物还原,制备高活性的低价碱土金属化合物,比如零价和一价的铍、一价的镁和钙( Nat. Chem ., 2016, 8 , 890, 点击阅读详细 ; JACS , 2020, 142 , 4560; Science , 2007, 318 , 1754; JACS , 2009, 131 , 2977)(图1a-c)。值得一提的是,低价碱土化合物拥有极强的小分子活化能力。不久前,德国 埃尔朗根-纽伦堡大学的 Sjoerd Harder课题组在 Science 上报道了低价钙化合物对惰性氮气的活化( Science , 2021, 371 , 1125, 点击阅读详细 )(图1d)。

图1. a) 零价和一价铍化合物;b) 一价的镁化合物;c) 一价的钙化合物 (有争议,在这个例子中钙可以看成一价或者二价);d) 钙中心对氮气的活化。图片来源: Nat. Chem., JACS, Science
零价态的碱土金属化合物可以看成金属的单原子形态。由于活性非常高,合成这类化合物十分具有挑战性(低价态s区元素化合物综述, Dalton Trans., 2011, 40 , 5659.)。Harder课题组之前报道过用钠或者钾来还原NacNac配体支撑的二价镁化合物,得到了一价镁化合物 II以及低价镁对苯的还原产物 III ( Angew. Chem. Int. Ed ., 2019, 58 , 607)(图2)。
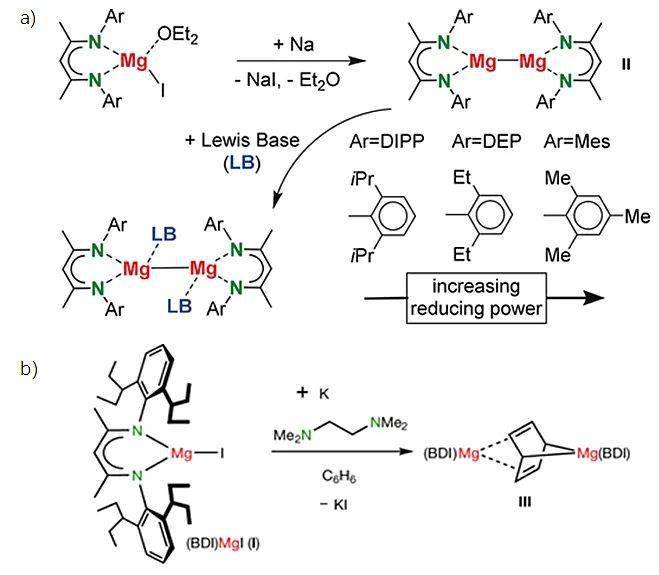
图2. a) 用钠还原二价镁化合物得到一价镁化合物 II; b) 用钾还原二价镁化合物得到化合物 III. 图片来源: Angew. Chem. Int. Ed.
无独有偶,通过 还原更大位阻的NacNac二价镁化合物,Harder课题组近期成功合成了一个具有 极强还原能力的零价镁化合物和一个MgI–Mg0–MgI团簇Nature 上。
作者利用Na/NaCl(Na分散于NaCl中)还原二价镁化合物(BDI*)MgI ( IV),合成了化合物[(BDI*)MgNa ]2 ( 1)(BDI*为大位阻的NacNac配体)(图3)。而如果用钾进行还原,则得到一价镁化合物 V。化合物 1的单晶结构显示其含有两个(BDI*)Mg结构基元,并被两个钠离子桥连在一起(图4a)。由于钠和BDI*配体上芳基的相互作用,因此对称性降低。镁和钠之间的长度为3.12 Å和3.45 Å,这和镁钠Bragg金属半径之和相似(3.19 Å)。两个镁之间的距离是5.78 Å,意味着它们之间没有明显的成键作用。尽管BDI*配体能够接纳不止一个电子,但是通过对化合物 1中BDI*配体的空间结构和碳氢化学位移值进行分析,作者认为没有发生从镁到配体的电荷转移,BDI*配体和镁分别显负一价和零价(钠是正一价)。
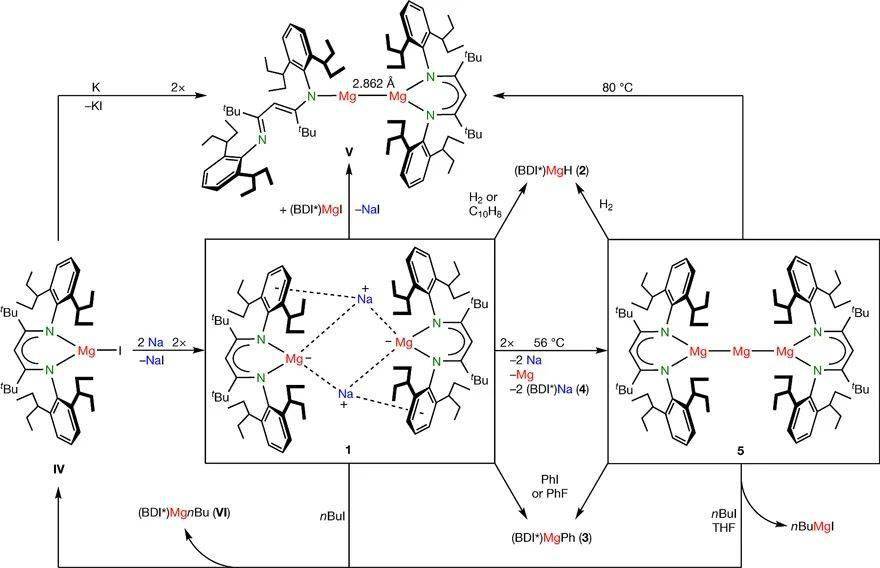
图3. 零价镁的合成和反应性。图片来源: Nature
自然键轨道(NBO)和分子中的原子理论(AIM)分析证实了化合物 1中镁的富电子性质(图4b)。BDI*配体的NPA电荷是-1.07 a.u.,和一价镁化合物 V中BDI*配体的电荷相近(-0.99 a.u.),说明化合物 1中镁确实没有大幅转移电子到BDI*配体。镁上的电荷是+0.57 a.u.(NPA)和+0.41 a.u.(AIM),钠上的电荷为+0.50 a.u.(NPA)和+0.74 a.u.(AIM)。而在正常的一价镁化合物 II中,镁的电荷是+0.98 a.u.(NPA)。此外,在有机钠化合物Na(BDI*)( 4) 中,钠的电荷是+0.91 a.u. (NPA) 和+0.89 a.u. (AIM)。这说明镁和钠的价态低于一价。Laplacian分布也表明,有一对电子主要分布在镁上(朝钠离子一侧极化)。因此,作者推测在化合物 1中,镁的电子部分转移到了钠离子上。化合物 1也可以看成是两个负一价BDI*配体稳定的 [Mg2 Na2 ]2+ 团簇。AIM和Wiberg键级分析支持镁钠成键(两个不对称镁钠键Wiberg键级分别为0.35和0.11),但是钠钠之间没有成键作用。
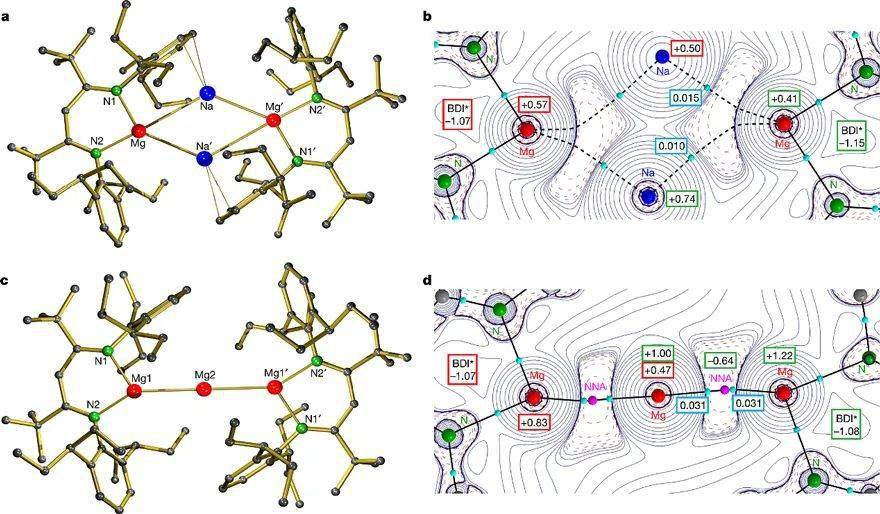
图4. a) 化合物 1的单晶结构;b) 化合物 1中[M g2 Na2 ]部分Laplacian分布;c) 化合物 5的单晶结构;d) 化合物 5中[M g3 ]部分Laplacian分布。对图b和d: 红框是NPA电荷,绿框是AIM电荷,蓝框是键零界点的电子密度。图片来源: Nature
随后,作者对化合物 1的反应性进行了探索(图3)。加入醚类溶剂或者穴醚(cryptands)会导致化合物 1分解。此外,试图将钠离子替换成锂或者钾离子也会导致 1分解。化合物 1和氢气反应生成二价镁氢化合物(BDI*)MgH ( 2)。化合物 1中(BDI*)Mg单元具有亲核性,可以和原料(BDI*)MgI ( IV)反应生成化合物 V。它和氟苯或者碘苯的反应都能生成(BDI*)MgPh ( 3)。化合物 1也可以从萘上拔质子生成(BDI*)MgH ( 2)。
在氘苯溶液中,液相核磁显示化合物 1具有高对称性,这表明它在溶液中发生了解离。在室温下,它在溶液中缓慢的分解。通过连续结晶的方式可以分离出来主要分解产物(BDI*)Na( 4)和少量(BDI*)Mg-Mg-Mg(BDI*) ( 5) (优化条件后9%产率)。对反应后生成的金属镜进行分析显示其成分是 Mg0 :Na0 = 1:2。基于此,作者推测 1的分解方式可能有两个,即 1 → 2(BDI*)M g•+ 2N a0 和 1 → 2(BDI*)Na + 2M g0 。化合物 5的生成可以看成是两个(BDI*)M g•自由基和M g0 结合。整体上,这个反应可以看成零价镁对钠离子的还原。
单晶结构显示化合物 5中的两个镁镁键长相同(2.89 Å)(图4c)。理论计算显示BDI*配体的NPA电荷是-1.07 a.u.,中心镁原子电荷是+0.47 a.u.,两侧的镁原子是+0.88 a.u.(和一价镁相当)(图4d)。综合考虑非核吸引作用,AIM分析得到的电荷是Mg(+0.90 a.u.)–Mg(+0.36 a.u.)–Mg(+0.90 a.u.)。因此,作者将化合物 5中的镁的氧化态描述为 MgI –Mg0 –MgI 。
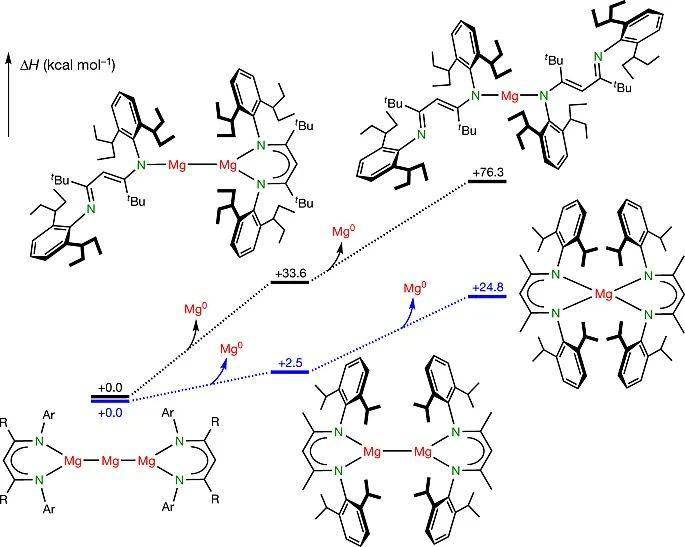
图5. 通过DFT计算得到的化合物 5以及类似物分解过程的焓变。图片来源: Nature
如图3所示,在60 °C下,化合物 5可以和氢气反应生成(BDI*)MgH ( 2) 和M g0 。在室温下它迅速和碘苯反应生成(BDI*)MgPh ( 3) 和Mg I2 。在-80 °C下,它和 nBuI的反应生成(BDI*)MgI ( IV) 和 (BDI*)Mg nBu ( VI) ,以及格氏试剂 nBuMgI。值得注意的是,早期的研究表明在镁和卤代烃生成格氏试剂的时候会经历镁团簇中间体 Mgn + ( Inorg. Chem ., 1984, 23 , 3602)。计算结果也表明这种带电的镁团簇会紧密结合,并且是线性的构型( J. Chem. Phys. , 1995, 103 , 1050)。但是,此类镁团簇却未能被分离鉴定。化合物 5是首例可以分离的、具有混合价态的镁团簇,为研究格氏试剂的生成机理提供了有力证据。
室温条件下,化合物 5在苯溶液中稳定很好。但是在80 °C下分解成(BDI*)MgMg(BDI*) ( V) 和M g0 。作者认为 5的稳定得益于BDI*配体的位阻效应。DFT计算可以用来阐明位阻对解离焓的影响。化合物 5解离出一个M g0 是焓增过程( 5 → V + M g0 ; ∆ H = +33.6 kcal mo l−1 )。由于位阻效应,在形成化合物 V的时候经历了一个Mg-N键的断裂,因此整个过程能量升高。考虑到从原子镁到固体镁放出热量( Mg(g) → Mg(s) ; ∆ H = −35.2 kcal mo l−1 ),因此化合物 5的分解接近等热过程。由此可以看出BDI*配体对化合物 5的稳定性还起到了动力学保护作用。如果换成小位阻的BDI配体,类似化合物的解离焓就降低了很多(图5)。
小结
Harder课题组通过还原大位阻配体稳定的二价镁化合物,成功合成了零价镁化合物以及镁团簇。笔者相信这些低价态镁化合物会在接下来的研究中展现出更多意想不到的碱土元素化学性质。
Strongly reducing magnesium(0) complexes
B. Rösch, T. X. Gentner, J. Eyselein, J. Langer, H. Elsen & S. Harder
Nature, 2021, 592 , 717–721. DOI: 10.1038/s41586-021-03401-w
(本文由 LLL_SUSTech供稿)
本文版权属于 X-MOL(x-mol.com),未经许可谢绝转载!欢迎读者朋友们分享到朋友圈or微博!