红细胞生成刺激剂(ESAs)是临床上治疗肾性贫血的常用药物,目前可供临床医师选择的有短效 ESAs 和长效 ESAs。短效 ESAs 在我国已广泛使用,历史悠久,国内外有众多指南共识。长效 ESAs 具有半衰期长、输注频次低、患者治疗依从性好等优势,近年来临床研究取得重要进展,但是尚缺乏长效 ESAs 临床规范使用的指导意见。
为此,中国非公立医院协会肾病透析专业委员会组织相关专家制定了《长效红细胞生成刺激剂治疗肾性贫血中国专家共识》,主要介绍了长效 ESAs 的分类、作用机制与药效学特点,在肾性贫血治疗中应用的适应证、时机、方案,特殊人群应用,不良反应及处理等,以指导长效 ESAs 类药物在肾性贫血治疗中的规范化使用。
长效 ESAs
分类、药物特点
1)新型红细胞生成刺激蛋白(NESP)
通用名为达依泊汀 α,是全球首个上市的长效 ESAs 制剂。其利用重组 DNA 技术对依泊汀 α 的分子结构加以改造,在原来 Asn24、Asn38 和 Asn83 糖基化位点基础上,分别在 Asn30 和 Asn88 位点上新增了两个 N 连接的糖基化位点。
2)甲氧基聚乙二醇红细胞生成素 β
一种持续性 EPO 受体激动剂(CERA)。CERA 是在完全糖基化的依泊汀 β 赖氨酸 N 末端氨基或 ε 氨基通过酰胺键连接 1 个甲氧基聚乙二醇链进行修饰。
聚乙二醇化的依泊汀 β 一方面通过增加药物相对分子质量(60000)从而降低肾脏清除率,另一方面可通过产生空间位阻效应,使修饰物免受蛋白酶水解,增加其稳定性,两者协同降低了药物的总清除率,显著延长了药物半衰期。
3. 促红细胞生成素模拟肽(EMP)
EMP 是一种化学合成模拟 EPO 的环状小分子肽,能够与细胞表面的 EPO 受体特异性结合,在体内外发挥与 EPO 相似的生物学效应。由于 EMP 在结构上与内源和重组 EPO 分子不同,与内源 EPO 无交叉抗原性,因此可以很大程度上减少抗 EPO 抗体介导的纯红细胞再生障碍性贫血(PRCA)的发生。
ESAs 临床应用
推荐意见
1
治疗对象
1)推荐长效 ESAs 用于治疗非透析依赖 CKD 患者合并的肾性贫血(1A)。
2)推荐长效 ESAs 用于治疗透析依赖 CKD 患者合并的肾性贫血(1A)。
3)建议对于短效 ESAs 低反应的肾性贫血患者,可使用长效 ESAs 进行治疗(2C)。
2
治疗时机及靶目标
1)推荐长效 ESAs 治疗肾性贫血的起始治疗时机为 Hb<100 g/L(1C)。
2)推荐长效 ESAs 治疗肾性贫血时,Hb 靶目标维持 ≥110 g/L,但不超过 130 g/L(1A)。
3
治疗方案
1)根据 CKD 患者治疗前 Hb 水平和临床情况决定长效 ESAs 的起始治疗剂量(1D)。
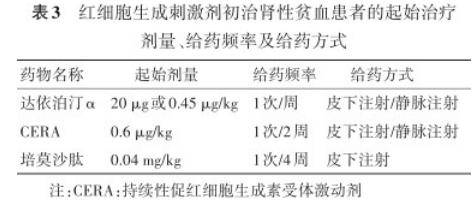
2)推荐对于 ESAs 初治的患者,达依泊汀 α 的起始剂量可给予固定剂量(20 μg)或根据体重计算(0.45 μg/kg),1 次/周,皮下或静脉注射;CERA 的起始剂量为 0.6 μg/kg,1 次/2 周,皮下或静脉注射;培莫沙肽的起始剂量为 0.04 mg/kg,1 次/4 周,皮下注射(1A)。
3)推荐对于正在使用短效 ESAs 治疗的患者,可根据目前短效 ESAs 的使用量按比例直接转换为长效 ESAs(1A)。
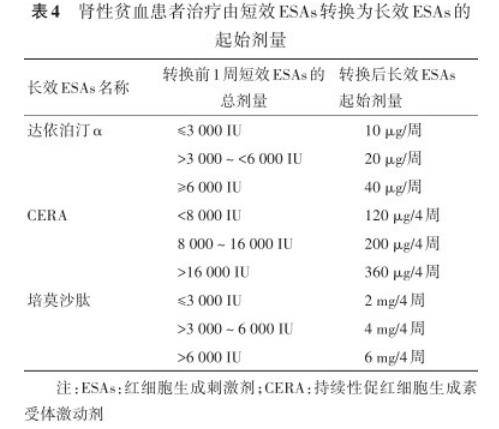
4)建议根据长效 ESAs 初始治疗期间 Hb 水平的上升速度以及维持治疗期间 Hb 水平的稳定性进行个体化剂量调整,将 Hb 水平维持于 110~120 g/L,Hb 的增长速度控制在每 4 周 10~20 g/L 以内(2D)。
4
治疗过程中铁代谢指标的监测和铁剂的应用
1)推荐在使用长效 ESAs 治疗前和治疗期间,定期检测 SF、TSAT 等铁代谢相关指标,至少每月检测 1 次,而对于贫血维持治疗阶段或Hb较为稳定的患者,至少每 3 个月检测 1 次(1C)。
2)在长效 ESAs 治疗期间,应维持 SF 200~500 μg/L,TSAT 20%~50%(2B)。
长效 ESAs
在特殊人群中的应用
推荐意见:在儿童、老年人群、肝功能不全、肾移植术后、肿瘤等特殊人群肾性贫血的治疗中,可考虑使用长效 ESAs(2B)。
1
儿童患者
关于长效 ESAs 在 CKD 儿童中应用的临床研究相对较少,尤其在中国 CKD 儿童中使用长效 ESAs 的安全性及有效性尚未明确。
结合现有研究证据,在 1~18 岁的 CKD 患儿中,对于 ESAs 初治者,建议达依泊汀 α 的起始剂量为 0.45 μg/kg,1 次/周,在非透析的 CKD 儿童中,可延长给药间隔,给予 0.75 μg/kg,1 次/ 2 周,与成人 CKD 推荐用量一致。而对从短效 ESAs 转换到达依泊汀 α 治疗的儿童,起始剂量可按照短效 ESAs :达依泊汀α 240∶1 进行剂量转换。
欧美 2 项多中心、开放标签、Ⅱ期临床研究分别纳入了 6~17 岁和 3 个月 ~ 18 岁正在接受其他 ESAs 治疗的 CKD 儿童,研究结果显示,调整为 CERA 后仍能安全且有效维持Hb在靶目标水平内。基于以上研究,在 3 月龄至 18 岁以下的 CKD 儿童中,对从短效 ESAs 或达依泊汀 α 转换为 CERA 治疗的儿童,建议按照以下公式确定:起始剂量 = 每月短效 ESAs 的使用总量(IU)/125,或每月达依泊汀 α 使用总量(μg)/0.55,用药频率为每 4 周 1 次。
2
老年患者
65 岁以上患者可无需调整起始剂量。国内外关于各种长效 ESAs 的 RCT 研究中,均包含 65 岁以上老年人群,部分研究中这一比例超过 50%,且老年患者与年轻患者之间未观察到明显的安全性或疗效的差异。
老年 CKD 患者通常合并多种心血管疾病,血栓栓塞等不良事件发生风险相对较高,因此,在使用长效 ESAs 时需进行个体化调整。
3
肝功能损害患者
达依泊汀 α 主要通过肝脏代谢清除,所有达依泊汀 α 的研究中均排除了合并活动性肝病的患者,因此,目前没有肝功能受损患者的使用数据,建议合并肝功能损害的 CKD 患者慎用达依泊汀 α 。
一项非随机、多中心、小样本研究指出严重肝功能损害不会影响 CERA 的药代动力学,故对于合并肝功能损害的 CKD 患者,理论上使用 CERA 时可无需调整使用剂量。
关于培莫沙肽在肝功能受损患者中的应用,一项群体药代动力学模型分析指出,轻度肝功能损害不会影响培莫沙肽的稳态暴露,但其在临床实践中的意义尚不明确,需开展进一步的研究。
4
肾移植术后患者
肾移植术后贫血患者可无需调整起始剂量。肾移植术后贫血发生率高达 30%~40%,与移植肾失功和全因死亡风险增加密切相关。
一项 RCT 研究和一些小样本观察性研究,证实了达依泊汀 α 和 CERA 是改善肾移植术后贫血的有效治疗手段。在这些研究中,长效 ESAs 的用药剂量和频率与成人 CKD 的推荐用量基本一致。
5
肿瘤患者
结合现有证据,对于接受骨髓抑制化疗、Hb ≤ 100 g/L 的肿瘤患者,进行个体化风险和获益评估后,可考虑予以达依泊汀 α 治疗,推荐起始剂量为 500 μg 或 6.75 μg/kg,每 3 周 1 次,皮下注射,使用期间需密切监测,个体化调整用药,避免 Hb 水平超过 120 g/L。
长效 ESAs
不良反应及处理
推荐意见:建议使用长效 ESAs 期间,应观察患者是否出现过敏、高血压、血栓栓塞及 PRCA 等不良反应,一经发现应予以积极治疗(1,未分级)。
1
高血压
血压升高是 ESAs 类药物使用过程中最常见的不良反应,现有循证医学证据不足以确定哪类 ESAs 在保持血压水平稳定方面更具有优势。
因此,在使用长效 ESAs 治疗期间,应密切监测血压,必要时采用合适的饮食干预或降压药物来控制血压。对于血压难以控制的患者,建议减少 ESAs 用药剂量或暂停给药。
2
血栓形成
ESAs 类药物治疗后由于红细胞生成增多、红细胞比容增高、血液黏度增加,血栓形成风险增加。
所有 ESAs 在使用期间均有发生心脑血管血栓栓塞的风险,现有循证医学证据尚不能明确何种 ESAs 在减少血栓栓塞事件上具有优势。
故在临床实践中,使用长效 ESAs 时应密切监测 Hb 的水平,及时调整药物剂量,避免 Hb 升高过快引起心脑血管血栓栓塞事件发生。
3
抗 EPO 抗体介导的 PRCA
PRCA 是 ESAs 治疗期间出现的一种罕见但严重的并发症,发生率为(0.02~0.03)/万人年。这是由于 ESAs 治疗刺激机体产生抗 EPO 抗体,进而与内源性 EPO 发生交叉反应所致。
PRCA 主要表现为ESAs 使用过程中出现的进行性加重的重度贫血,即使加大 ESAs 剂量也难以纠正。
抗体介导的 PRCA 很少可以自限,通常需要积极治疗,免疫抑制剂和肾移植是目前最有效的治疗方法;同时,鉴于抗体可能发生交叉反应,应立即停止当前使用的 ESAs ,且不推荐调整为另一种 ESAs 治疗。
但也有一些病例报道和临床研究指出,使用短效 ESAs 治疗后发生的 PRCA ,给予长效 ESAs 治疗仍有效,未来尚需进一步深入研究。
4
其他
使用长效 ESAs 类药物期间有极少数患者可出现超敏反应,包括过敏症、血管性水肿、支气管痉挛、皮疹以及荨麻疹;重度皮肤不良反应包括水疱、皮肤剥脱反应、多形性红斑、Stevens-Johnson 综合征、中毒性表皮坏死松解症。一旦发生上述情况,应立即停止使用。
特别说明 | 本文仅供医疗卫生等专业人士参考
策划 | TAT
投稿及合作 | huangwendi@dxy.cn
内容来源:
[1] 中国非公立医院协会肾病透析专业委员会共识专家组. 长效红细胞生成刺激剂治疗肾性贫血中国专家共识(2024年版)[J]. 中华肾脏病杂志, 2024, 40(2): 146-157. DOI: 10.3760/cma.j.cn441217-20231025-01037.