01简介
随着分子生物学和细胞生物学的不断发展,细胞转染已经成为研究真核细胞基因功能的主要手段之一,广泛应用于基因功能解析、表达调控、突变分析以及蛋白质生产等领域。
细胞转染是将外源遗传物质(如DNA或RNA)导入真核细胞的技术。这种技术通常可分为两大类:瞬时转染和稳定转染。
瞬时转染是指外源DNA/RNA未整合到宿主染色体,导致宿主细胞内存在多个拷贝数,从而实现高水平表达。但是,这种高水平表达只能持续数天。使用超螺旋质粒DNA进行瞬时转染效率最高,因为这种DNA能够被细胞更有效地摄取。
稳定转染则是将外源DNA整合到细胞基因组中,或者将其存在于游离型质粒中,并且可以传递至转染细胞的子代。通常情况下,只有少数外源DNA拷贝能够整合到稳定转染基因组中,导致稳定转染基因的表达水平较瞬时转染低。鉴于外源DNA整合到基因组的概率较低,常常在转染的DNA构建中加入可筛选标记物,例如产生药物抗性的基因或对缺陷细胞系进行补偿的必需基因,然后在短暂恢复期后施加适当的筛选压力。
02转染方式
化学方法利用特定的载体分子包被核酸,使其带有中性电荷或正电荷,例如阳离子脂质体转染法、磷酸钙共沉淀法等。
生物方法则是利用基因工程病毒将非病毒基因转染到细胞中,常见的方法是通过病毒感染实现。
物理方法则通过在细胞膜表面生成一个短暂的孔来导入DNA,典型的例子是电穿孔法。
03实验方法
以脂质体转染法为例:
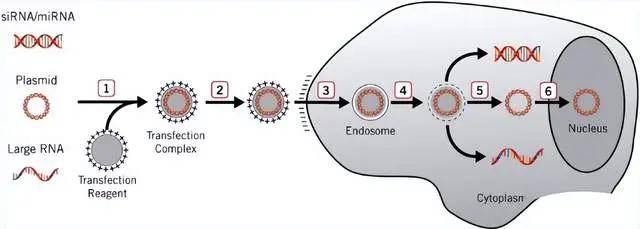
原理:脂质体转染法利用带有正电荷的阳离子脂质体与DNA的磷酸根通过静电作用结合,形成DNA-脂质体复合物。这些复合物能够被带有负电荷的细胞膜吸附,并通过融合或细胞内吞作用进入细胞。脂质体转染适用于悬浮或贴壁培养的细胞,是实验室中最常用的转染方法之一,具有较高的转染率,优于磷酸钙法。然而,由于脂质体对细胞具有一定毒性,因此通常转染时间不超过24小时。

 (图片来源于网络)
(图片来源于网络)
特点:脂质体转染法在细胞转染领域具有多种优势。首先,它能够高效地转染多种细胞系,使其成为适用于高通量筛选的理想选择。其次,脂质体转染法能够成功递送各种大小的DNA、RNA和蛋白质,不论是稳定表达还是瞬时表达都能够实现。另外,与其他化学方法不同的是,脂质体转染法还可以用于将DNA和RNA引入动物和人体内,拓展了其在基因治疗等领域的应用潜力。然而,值得注意的是,转染效率受到细胞类型和培养条件的影响,因此需要针对每种细胞类型进行转染条件和试剂的优化。
04实验材料、试剂、仪器
脂质体转染试剂:使用的是Promega公司的TransFast脂质体试剂,它是一种阳离子脂质体和中性脂质体的混合物,专为优化在实验中使用的293T细胞的转染效率而设计。
细胞和质粒:包括293T细胞、MyoD表达质粒、EGFP表达质粒。
培养基和试剂:DMEM培养基、青霉素、FCS、PBS、EDTA、链霉素、小牛血清。
仪器和实验工具:微量移液器、Tip头、涡旋振荡器、恒温水浴箱、台式离心机、培养皿、转染管、离心管、倒置显微镜(用于观察)、荧光显微镜(用于观察荧光标记的细胞)、CCD(用于图像捕获)。
05实验步骤
一、细胞传代
1、试验准备:200 ul/1mlTip头各一盒(以上物品均需高压灭菌),酒精棉球,废液缸,试管架,微量移液器,记号笔,培养皿,离心管。
2、弃掉培养皿中的培养基,用1 ml的PBS溶液洗涤两次。
3、用Tip头加入1 ml Trypsin液,消化1分钟(37℃,5%CO2)。用手轻拍培养瓶壁,观察到细胞完全从壁上脱落下来为止。
4、加入1 ml的含血清培养基终止反应。
5、用Tip头多次吹吸,使细胞完全分散开。
6、将培养液装入离心管中,1000 rpm离心5 min。
7、用培养液重悬细胞,细胞计数后选择0.8X106个细胞加入一个35mm培养皿。
8、将合适体积完全培养液加入离心管中,混匀细胞后轻轻加入培养皿中,使其均匀分布。
9、将培养皿转入CO2培养箱中培养,第二天转染。
二、细胞转染
1. 转染试剂准备:首先,在试剂管中加入400微升去核酸酶水,进行10秒钟的震荡,以确保溶解脂状物。之后,将试剂保存在-20℃,使用前再次震荡。
2. 混合比例选择:在转染管中,按照适当的比例(1:1-1:2/脂质体体积:DNA质量),加入适量的无血清培养基,然后加入适量的MyoD或EGFP的DNA,最后加入适量的转染试剂,进行震荡混合。
3. 混合液静置:将混合液在室温放置10-15分钟,以促进有效的DNA与转染试剂的结合。
4. 培养基清洗:吸去培养板中的培养基,然后用PBS或者无血清培养基进行一次清洗,以减少转染试剂对细胞的干扰。
5. 加入混合液:将混合液加入培养皿中,然后将细胞放回培养箱中培养一个小时,以确保转染试剂与细胞充分接触。
6. 继续培养:到指定时间后,根据细胞类型决定是否移除混合液,然后加入完全培养基,继续培养24-48小时,以促进转染基因的表达和细胞的增殖。
三、第二次细胞传代
第二次细胞传代是细胞转染后的重要步骤,具体操作如下:
1. 转染后24小时内,观察和记录绿色荧光蛋白的表达情况,以评估转染效果和基因表达水平。
2. 再次进行细胞传代,以0.8X10^5个细胞/35 mm培养皿的适当密度重新悬浮并培养,确保细胞在新的培养条件下继续生长和扩增。
3. 在正常的培养条件下,培养细胞24小时,然后根据需要进行适当的固定处理,例如染色或其他实验操作。
4. 如果需要进一步优化转染条件,可以参考TransFast的使用说明书,进行相应的参数调整和优化实验。
06细胞转染注意事项
1. 培养基中的成分:转染前需使用无血清的培养基,因为血清会影响DNA-阳离子脂质体复合物的形成。尽管在转染过程中可以添加血清,但在形成复合物的过程中需保持无血清条件。
2. 抗生素的使用:抗生素可能影响转染效率,因为阳离子脂质体试剂增加了细胞的通透性,使抗生素进入细胞,降低细胞活性,从而降低转染效率。使用不含脂质体的试剂,如英格恩生物的Entranster转染试剂,可以在培养基中加入抗生素,避免细胞染菌。
3. 设置阳性和阴性对照:在转染过程中设立适当的阳性和阴性对照有助于验证转染效果。一般在转染24-48小时后,靶基因开始在细胞内表达,根据实验目的选择合适的时间进行表达检测实验。
4. 质粒DNA的纯度和质量:用于转染的质粒DNA必须无蛋白质、无RNA和其他化学物质的污染,OD260/280比值应在1.8以上,以确保最佳的转染效率和基因表达。
5. 转染细胞的密度:转染当日的细胞密度应在70-90%(贴壁细胞)或2×10^6-4×10^6细胞/ml(悬浮细胞)为宜,以确保最佳的转染效率和基因表达水平。
这些因素综合影响着转染效率和转染后的基因表达情况,对于实验结果的准确性和可重复性具有重要意义。
总结
并没有一种通用方法适用于所有细胞类型和实验需求。各种转染方法在转染效率、细胞毒性、对正常生理的影响以及基因表达水平等方面存在差异。因此,在选择转染方法时,需考虑具体的细胞类型和实验需求。理想的方法应具备高转染效率、低细胞毒性、最小程度的生理影响,易于操作且具有高重复性。此外,需要对选定的方法进行各种转染条件的优化,以建立一个稳定可靠的实验方案。