2023 ASCO-GU
2023年美国临床肿瘤学会泌尿男生殖系肿瘤分会(ASCO-GU)年会于当地时间2023年2月16日至18日在旧金山盛大召开。尿路上皮癌在治疗及生物标志物的探索方面有多项研究公布结果,小编整理了其中8项重点研究跟大家一起分享。
01 HCRN GU 16-257研究共同主要终点分析:吉西他滨、顺铂联合纳武利尤治疗选择性保膀胱的MIBC(摘要号:447)
该研究是一项多中心2期试验,共入组了76个顺铂耐受cT2-T4aN0M0的尿路上皮膀胱癌患者,其在接受4周期的吉西他滨、顺铂联合纳武利尤治疗后,根据尿液细胞学、膀胱MRI/CT、膀胱镜检查和膀胱活检进行临床再分期,达到临床完全缓解(cCR)(细胞学及影像学正常,cT0/Ta)的患者则不进行膀胱切除术,并接受8个周期的纳武利尤单抗(q2wk)治疗和监测,没有达到cCR的患者建议行膀胱切除术。研究的主要终点是cCR率和2年生存结局。
此次报道的数据中,有72/76例进行临床再分期,33/76例(43%)患者获得cCR,其中1例患者即刻行膀胱切除术(ypTaN0M0)。基线TMB≥10个突变/mb与ypT0或者2年的膀胱无转移生存期显著相关。cCR和非cCR患者的2年生存率分别为100%和75.8%。该研究表明TURBT术后纳武利尤联合GC的治疗方案,可获得较高的cCR率,而且绝大多数达到cCR的患者可以实现≥2年保膀胱生存期。
02 3期IMvigor130研究:阿替利珠(atezo)联合化疗对比化疗一线治疗局部晚期或转移性尿路上皮癌(mUC)最终总生存期(OS)分析(摘要号:LBA440)
该项研究报道了IMvigor130研究的A组(atezo+化疗)与C组(铂/吉西他滨)治疗局部晚期或mUC的最终OS分析结果。截至数据获取日期,A组患者并没有显著的OS获益。在CIS亚组中,HR为0.76(95%CI:0.57-1.01)。A组与C组的DCR分别为65%,60%。3/4级不良反应在A组与C组的发生率分别为81% vs 80%。因此,在最终分析结果中,相较于化疗,atezo联合化疗并未显著改善mUC患者的OS。
03 3期IMvigor130研究:阿替利珠(atezo)单药与化疗治疗局部晚期或转移性尿路上皮癌(mUC)最终总生存期(OS)分析(摘要号:LBA441)
IMvigor130研究的两项中期OS分析证实了atezo单药与铂/吉西他滨相比,并没有显著改善PD-L1高表达(IC2/3) mUC患者的OS。探索性数据显示了atezo单药在CIS不耐受但PD-L1高表达的患者有临床获益。本次ASCO-GU大会报道了IMvigor130研究B组(atezo)或C组(铂/吉西他滨)OS最终分析结果。截至数据获取日期,B组患者没有显出OS获益,而CIS不耐受但PD-L1高表达患者亚组中的HR 为0.56 (95%CI:0.34, 0.91)。ITT人群,B组对比C组1年的OS率,ORR,中位DOR分别为34% vs 32%,24% vs 44%,29.6 mo vs 8.1mo。在CIS不耐受但PD-L1高表达人群中,B组与C组的ORR分别为40%与33%。在安全性方面,3/4级不良反应在B组与C组的发生率分别为16% vs 80%。总体而言,研究最终OS分析与之前报道的结果一致,与化疗相比,atezo单药并没有显著改善患者OS,但其耐受性优于化疗。
04 UNITE研究分析:EV治疗晚期尿路上皮癌(aUC)患者响应的分子标记物(摘要号:450)
EV是一种以Nectin-4为靶点的抗体-药物偶联物(ADC),已经广泛用于治疗难治性aUC。该项研究分析了UNITE研究队列中对EV治疗响应的潜在生物标记物。研究纳入接受≥1剂EV治疗患者,由研究者进行ORR评估。评估的生物标志物包括肿瘤突变负担(TMB)、PD-L1状态、体细胞改变 (TERTp、TP53、ARID1A、CDKN2A、CDKN2B、FGFR3、ERBB2、CCND1、 KDM6A、MTAP、PIK3CA、RB1、TSC1)频率>10%,以及出现1个及以上DDR基因(ATM、 BARD1、BRCA1、BRCA2、CDK12、CHEK2、PALB2、PPP2R2A或RAD51B)突变。在最终纳入的有临床结果以及NGS数据的170个患者中,总体ORR为47%,中位PFS为6mo,中位OS为12mo。其中携带ERBB2(67% vs 44%)以及TSC1(68% vs 25%)突变的患者ORR显著高于野生型患者。而携带CDKN2A、CDKN2B和MTAP突变患者的中位PFS更短。高TMB患者的中位OS更长。
05 免疫检查点抑制剂治疗转移性尿路上皮癌的生物标记物探索(摘要号:532)
该项研究分析了患者体细胞突变频率>10% 的基因 (ARID1A、CCND1、CDKN2A、CDKN2B、 ERBB2、FGF3、FGF4、FGF19、FGFR3、KDM6A、MDM2、MLL2、PIK3CA、RB1、TERTp、 TP53、TSC1), DDR基因突变以及TMB对患者接受免疫治疗疗效的影响。结果显示,107例患者有NGS检测数据,其中有51%接受一线免疫治疗。总体ORR为35%,中位PFS为3.9mo(95%CI:2.6-7.5mo),中位OS为17.4mo(95%CI:14.1-30.6mo)。携带ARID1A和DDR突变,以及高TMB(>10 mut/mb)的患者对免疫治疗的响应更佳,是独立影响疗效因素。而携带CDKN2B、 KDM6A、 FGF3、 FGF4和FGF19突变的患者接受免疫治疗的效果差。
06 基于尿液与血液cfDNA检测膀胱癌的比较(摘要号:450)
该项研究评估了尿液cfDNA(ucfDNA)甲基化模式在可疑膀胱病变患者检测膀胱癌中的效能,并与使用血浆cfDNA(pcfDNA)检测进行比较。研究收集了17例疑似新发以及20例疑似复发的NMIBC,以及16例非癌泌尿系统疾病患者的尿液和血液。疑似NMIBC的患者通过经尿道膀胱切除术及影像进行诊断和分期。通过训练膀胱癌组织(N=49) 对比外部参考数据集(N=176) 富集的甲基化模式确定尿液cfDNA肿瘤等位基因分数(TAF)。此外,将一部分非癌患者尿液样本(N=50)的最大TAF设置为检测阈值,以确定尿液cfDNA检测膀胱癌的敏感性。血浆cfDNA的敏感性通过一个经验证特异性为99%的MCED检测分类器来计算。结果显示,对于新发NMIBC,ucfDNA检测总体的敏感性为91.7% (11/12;95% CI:61.5-99.8%),高级别患者中为90% (9/10);pcfDNA检测总体的敏感性为16.7% (2/12),高级别患者中为10.0%(1/10)。对于疑似NMIBC复发患者,ucfDNA检测敏感性总体为78.6% (11/14;95% ci 49.2-95.3%),高级别患者中为100%(11/11);pcfDNA检测敏感性总体为14.3%(2/14),高级别患者中为18.2% (2/11)。值得注意的是,16例NC患者和5例怀疑新NMIBC患者但确诊为良性患者的尿液中检测的TAF均低于检测阈值。在疑似复发性NMIBC但TURBT未发现肿瘤的患者中, 4/6 (66.7%)患者尿液的TAF高于检测阈值。研究表明,通过尿液检测cfDNA甲基化的敏感性高于血浆。
07 尿液ctDNA作为NMIBC患者二次TURBT前的MRD检测:一项前瞻性研究(摘要号:445)
这项前瞻性研究评估了尿液ctDNA在NMIBC患者行二次经尿道膀胱肿瘤切除术 (rTURBT) 时检测MRD的潜力。研究入组了11例高危NMIBC患者,对其指标肿瘤(Index tumor)和rTURBT的肿瘤组织进行全外显子组基因测序(WES)。在rTURBT术前收集患者尿液样本进行超深度utDNA测序。结果显示,8/11(73%)患者在rTURBT时检测到了残留肿瘤。WES鉴定出50个基因在至少两个样本中发生非同义突变,包括TP53、PIK3CA、RB1、MYC、CDKN1A和ARID1A。在utDNA检测中,10/11例(91%)患者检测到肿瘤特征性变异。总体而言,50%的utDNA突变与指标肿瘤组织一致,39%与rTURBT组织一致,33%三者均一致。二次电切术中有可见肿瘤的患者,显示出更高的utDNA肿瘤分数(2.5% vs 0.2%,P=0.10)。utDNA阳性预测MRD的敏感性为75%,特异性为100%,AUC为0.85。研究结果表明,utDNA与指标肿瘤的一致性相较于二次电切组织与指标肿瘤的一致性更好。utDNA肿瘤分数用于预测MRD具有较高的特异性及敏感性。
08 基于肿瘤知情的ctDNA-MRD检测在浸润性膀胱癌中的临床实践(摘要号:532)
该研究评估了检测(Signatera)在1-4期膀胱癌(经TURBT或放疗或根治性膀胱切除)的诊断表现。在最终19例患者的MRD检测结果中,9例有连续监测。13/19例患者在任何时间点均发现ctDNA阳性结果。初始检测阳性率与肿瘤分期相关:stage 1期:3/5,其中2例行TURBT、1例行根治性膀胱切除术;stage 2期:2/5;stage 3期:6/8;stage 4期:0/1。在连续检测的9例患者中,1例患者的结果在监测期间由阴性转化为高阳性,辅助治疗后随后下降为低阳性。1例患者最初连续2次低阳性,经全身治疗及放疗转阴。7/19例患者在大约4-13个月的时间内完成了3次或3次以上的检测,其中2例始终呈阴性结果。大多数ctDNA阳性的患者在ctDNA检测后2-3个月内确实表现出影像学复发。结果证实,膀胱癌切除术后ctDNA阳性是常见的。肿瘤知情的 ctDNA-MRD检测具有非常高的敏感性,但一次性阴性检测结果不能排除转移性疾病的存在。上述数据显示癌症分期与阳性结果之间存在关联,特别是在晚期。1期阳性结果可能是由于切除不充分所致。ctDNA升高可能代表早期复发,并可能通过早期全身治疗恢复到ctDNA阴性而得到挽救。
近年来,随着各种诊疗方案的进一步研究及精准医学的发展,让尿路上皮癌的治疗进入了一个崭新的时代。通过基因检测技术,明确病变基因,采取精准的靶向治疗和免疫治疗,为尿路上皮癌患者带来更大获益。
仁东医学作为第一家专注在泌尿系统肿瘤基因检测的诊断公司,围绕尿路上皮癌的发病特点和诊疗规范,设计并推出了全系列涵盖早期筛查、辅助诊断、用药指导、动态监控和遗传咨询的精准诊疗基因检测产品,致力于提供最好的产品和诊疗一体化服务,造福广大尿路上皮癌患者。【拓展阅读:肿瘤基因检测产品:尿路上皮癌产品介绍】
仁东医学尿路上皮癌基因检测产品
优可安™-尿路上皮癌精准诊疗基因检测
全面涵盖尿路上皮癌预后、靶向、化疗、免疫及遗传相关基因
辅助临床做到膀胱癌的精准诊疗
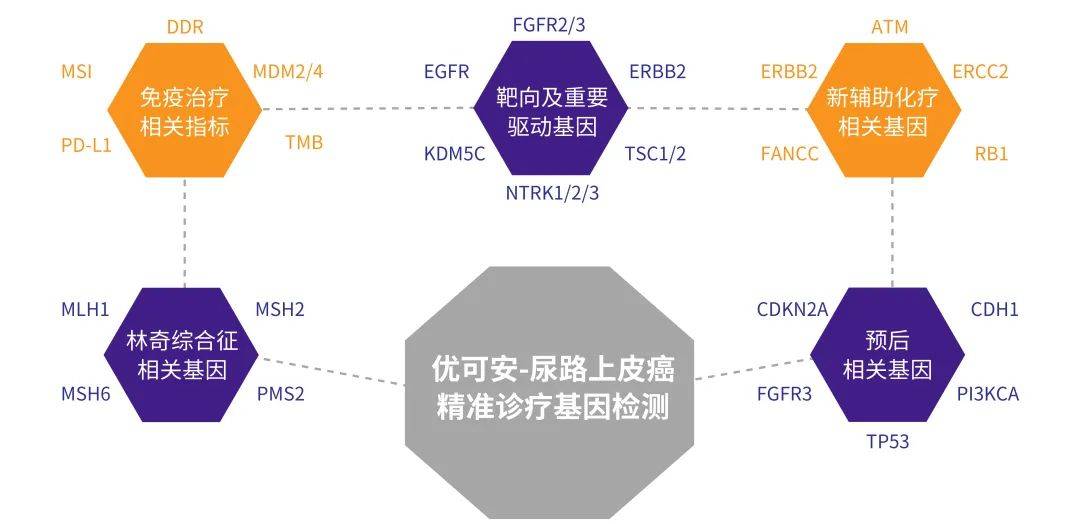
多位一体的精准诊疗方案,解决患者不同的临床需求
- 评估靶向及免疫药物疗效,为晚期尿路上皮癌患者提供潜在获益的药物选择
- 提示新辅助化疗疗效,辅助临床对患者的精准管理
- 提示患者家族遗传风险,辅助临床找到或排除病因
仁东医学
仁东医学成立于2015年12月,致力于成为肿瘤精准诊疗一体化解决方案的领导者,拥有先进完善的检测技术平台,强大的产学研转化能力和临床产品开发能力。公司总部位于苏州市吴中区,在上海和苏州拥有近6000平方米医学检验实验室,在苏州拥有1000多平方米的GMP生产基地,在北京设有仁东医学肿瘤精准研究院,并在全国29个省市实现了渠道网络覆盖,设有业务推广和学术支持团队。
仁东医学作为肿瘤精准诊疗领军企业,依托于特有的基因检测技术平台和其他多组学多维度平台,坚持用先进可靠的技术为临床服务,通过自主研发和国际合作引进的创新产品和技术服务,聚焦垂直瘤种的临床应用和转化研究,助力临床决策。在泌尿肿瘤(前列腺癌、膀胱癌、肾癌)领域形成了完善的解决方案,市场认可度和占有率遥遥领先。