本文内容速览:
什么是蛋白质组学?
1995年,Marc Wilkins提出“proteome”(蛋白质组)的概念,proteome是由蛋白质“protein”中的“prote”和基因组“genome”中的“ome”组合而来,是指一个基因组所表达的全部蛋白质信息,包括一个细胞、组织器官或一个生物体所表达的全部蛋白质信息(Swinbanks D, 1995)。与基因组学相比,蛋白质通过与基因组之间发生相互作用从而影响蛋白质的表达,因此在不同的生命阶段、不同的组织部位、不同的生长环境下,其蛋白的表达可能存在一定的差异。因此,蛋白质组学旨在通过高分辨率质谱和生物信息学技术,从整体水平上对特定环境或时间下细胞或组织内基因组所表达的全部蛋白质结构和功能进行研究。
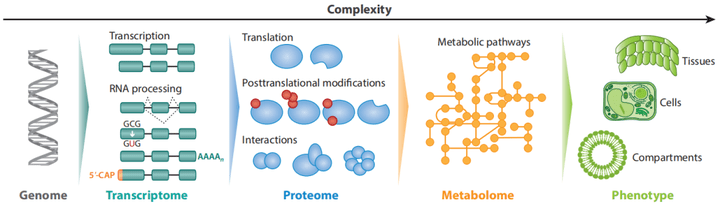
图1 植物主要是由植物细胞组成的,不同的细胞由不同的分子组成,不同的分子并非是独立发挥作用的,而是通过复杂的相互作用,构建成系统的生物网络,从而行使生命过程(Mergner J and Kuster B, 2022)。
蛋白质组学主要的研究内容
蛋白质是生理功能的执行者,是生命现象的直接体现者,对蛋白质结构和功能的研究将直接阐明生命在生理或病理条件下的变化机制。目前,蛋白质组研究主要包括三个方面的内容,分别是表达蛋白质组学、结构蛋白质组学和功能蛋白质组学(Meichao et al., 2021)。
表达蛋白质组学有助于鉴定特定组织样品中的主要蛋白质,或者不同组别样品中差异表达的蛋白质;结构蛋白质组学侧重于亚细胞蛋白质组的分析,对特定细胞器中的蛋白质进行研究,可绘制出蛋白复合物的结构,对探索植物细胞整体结构、细胞组成及通路网络具有重要意义;功能蛋白质组学其实是蛋白质组研究的终极目标,可阐明与特定功能相关蛋白质的活动规律,提供蛋白质信号、作用机制和蛋白-蛋白互作的重要信息。
蛋白质组学主要的工作流程
蛋白质组学主要通过高分辨率质谱技术对组织或细胞中的蛋白质进行定性和定量分析,具有整体性和组织特异性的特点。其主要的工作流程包括蛋白的提取、酶解成肽段、质谱检测和数据分析等。
1)蛋白的提取:与动物或细菌样本相比,植物细胞的蛋白质体积比相对较低,主要是因为植物细胞的大部分是由细胞壁和液泡组成的,所以需要大量的植物材料来获得足够的蛋白质。其中细胞壁的破裂程度决定蛋白提取的效率,而且细胞壁和液泡都含有大量的物质,包括酚类化合物、蛋白水解酶和氧化酶、萜烯、色素和碳水化合物等,这些物质均会干扰蛋白质样品的制备,因此选择合适的细胞壁破碎方法至关重要。
目前破碎细胞壁的方法主要有液氮研钵研磨法和珠磨法。液氮研钵研磨法在液氮低温的状态下使蛋白不易被降解,是常用的细胞破碎方法。然后采用TCA沉淀法对溶液中的蛋白进行沉淀,通过三氯乙酸/丙酮、氯仿等有机试剂对植物色素进行处理,结合裂解液对样本中的蛋白进行充分的提取。
2)酶解成肽段:得到蛋白溶液后,需要通过蛋白酶解的方式把蛋白水解成肽段,最常见的酶解方式是用胰蛋白酶处理、用赖氨酸-C(Lys-C)处理或二者混合处理,主要是因为这些酶解方式产生的肽段长度和电荷分布比较适合于液相色谱-串联质谱的分析。对于翻译后修饰蛋白需要进行富集处理,主要有抗体富集、化学衍生化(不依赖于抗体,在蛋白结构上面加入一个基团,此基团具有富集蛋白的作用)、螯合作用等方法。
3)质谱检测和数据分析:通过上述步骤制备的肽段样本最终通过液相色谱-串联质谱法(LC-MS/MS)进行分析,经过生物信息学分析挖掘有价值的信息,对蛋白的结构和功能进行预测,为探究功能机制提供研究基础(Mergner et al., 2022)。
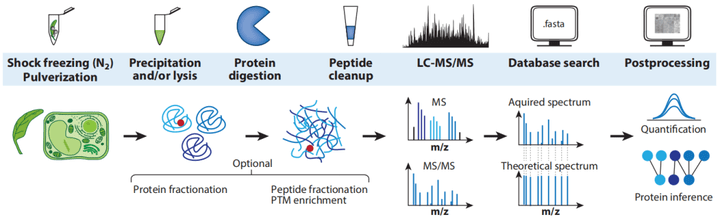
图2 蛋白质组学样品制备、数据采集和分析的一般工作流程(Mergner J and Kuster B, 2022)。备注:LC-MS/MS,液相色谱-串联质谱法;MS,质谱;MS/MS,串联质谱法;m/z,质荷比;PTM,翻译后修饰。
蛋白质组学如何提高作物产量
一直以来,在粮食作物产量方面尽管基因测序技术提供了大量的信息,但是完整基因组序列提供的信息不足以阐明具体的生物学功能。植物细胞通常会通过多种蛋白和代谢的调节途径发挥生物学功能,而蛋白质组学是在特定的时间、特定的条件下对生物体中的蛋白表达情况进行综合分析,因此了解蛋白质组在生物系统中发挥的功能或作用,对提高作物产量、确保粮食安全意义重大(Tan B et al., 2017)。接下来就让伯小远带大家一起盘点一下蛋白质组学在作物产量方面的研究应用吧!
1)改善籽粒形状——籽粒长度
籽粒形状(如长度)是重要的育种性状之一。长而细的粮食品种在国际市场上很受欢迎,受到大多数消费者的青睐。为了更好的了解籽粒长度的分子调控机制,本研究通过质谱技术对籽粒长度的调控蛋白进行研究,为改善籽粒形状提供更多的应用价值。
2023年,广西农业科学院水稻研究所邓国富课题组在Journal of Proteomics杂志上发表了题为“TMT-based quantitative proteomic analysis of indica rice cultivars reveals that novel components of the signaling pathways might play a role in grain length regulation”的研究论文,为了更好地了解籼稻籽粒长度调控的蛋白质,研究人员收集了长粒水稻品种和短粒水稻品种,通过TMT标记蛋白质组学技术对差异调控的蛋白质进行了鉴定和定量分析,并结合GO和KEGG对差异蛋白的富集情况进行了解释。
此外也做了一系列的验证实验,比如通过PRM靶向蛋白质组学对差异表达蛋白进行了定量分析,其结果几乎与TMT定量分析一致。通过qRT-PCR分析,结果显示转录水平与蛋白含量的变化并不总是一致的。该研究通过定量蛋白质组学方法鉴定了4个新的与粒长相关的蛋白(A2XTE8、B8B3X6、B8B9G7和A2WRZ6),为进一步研究籽粒粒长调控机制提供了候选基因(Qing et al., 2023)。
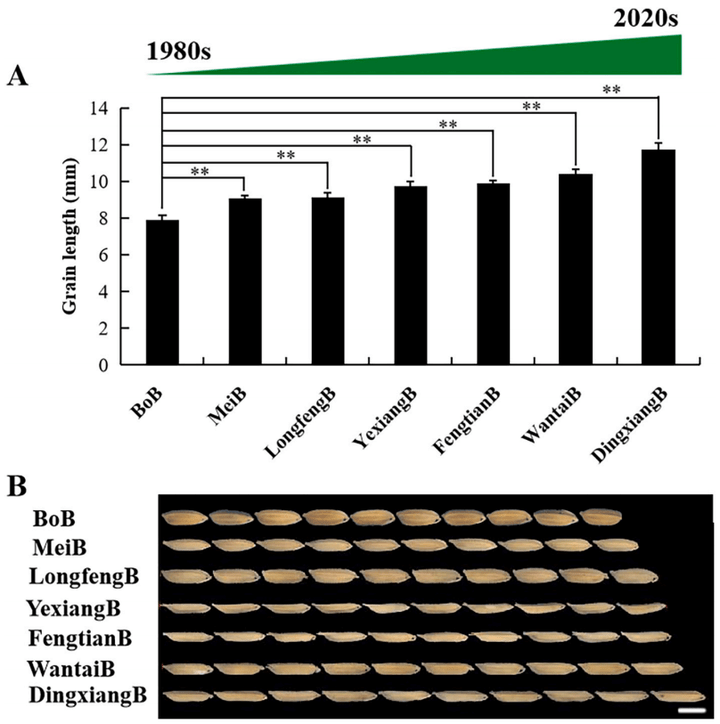
图3 不同品种大米粒长测定(Qing et al., 2023)。(A)谷粒长度。(B)各品种籽粒长度比较。
为了鉴定水稻籽粒长度调控蛋白,研究人员使用TMT标记蛋白质组学对6个长粒水稻品种和短粒水稻品种进行测定(图4)。
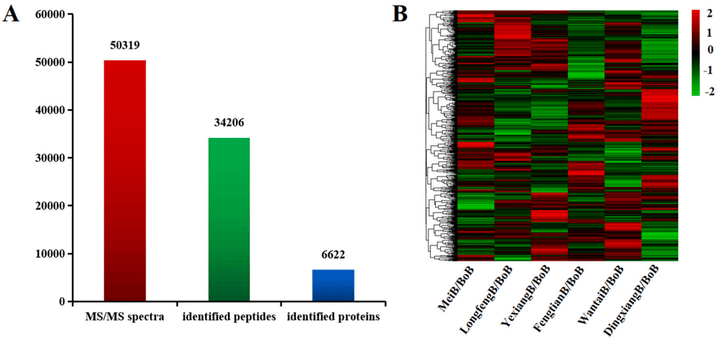
图4 长粒和短粒品种鉴定出的差异表达蛋白信息的统计和层次聚类分析(Qing et al., 2023)。(A)TMT标记蛋白质组学分析的蛋白质组基本信息统计。采用MaxQuant软件对蛋白质进行鉴定,MS/MS为二级质谱信息。(B)将长粒品种(MeiB、LongfengB、YexiangB、FengtianB、WantaiB和DingxiangB)与短粒品种(BoB)进行聚类分析。
通过统计图和维恩图的形式,对差异调控的蛋白质进行了鉴定和定量分析。通过比较6个长粒和短粒品种的蛋白质含量,对检测到的6622个蛋白质进行了定量分析,其中715个蛋白质受到显著调控,包括336个显著上调蛋白和355个显著下调蛋白(图5)。
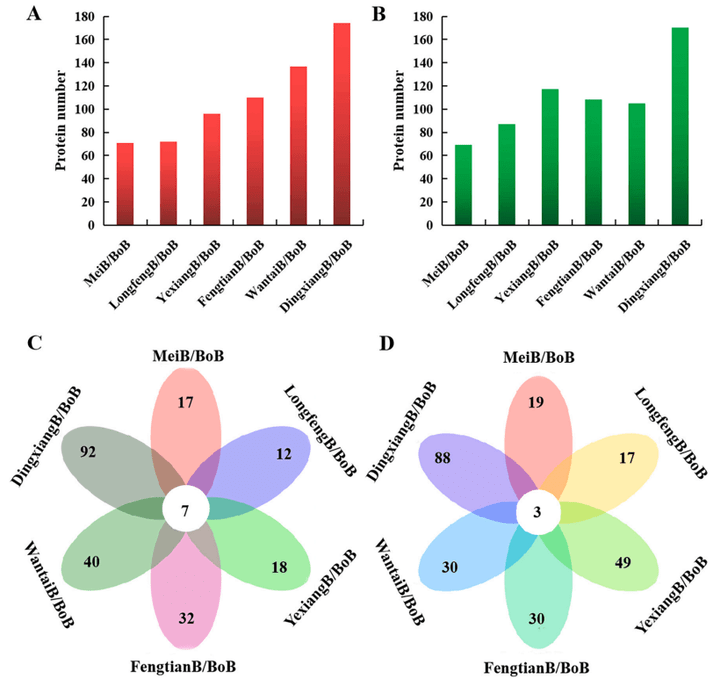
图5 统计图和维恩图显示了通过6个长粒品种和短粒品种鉴定出的差异表达蛋白数量(Qing et al., 2023)。(A、B)上调、下调蛋白的统计分析。(C、D)上调、下调蛋白的维恩图分析。
差异表达蛋白的GO分析显示,长粒品种在生物过程(主要是细胞过程、代谢过程和胁迫响应)、细胞成分和分子功能上面显著富集(图6)。
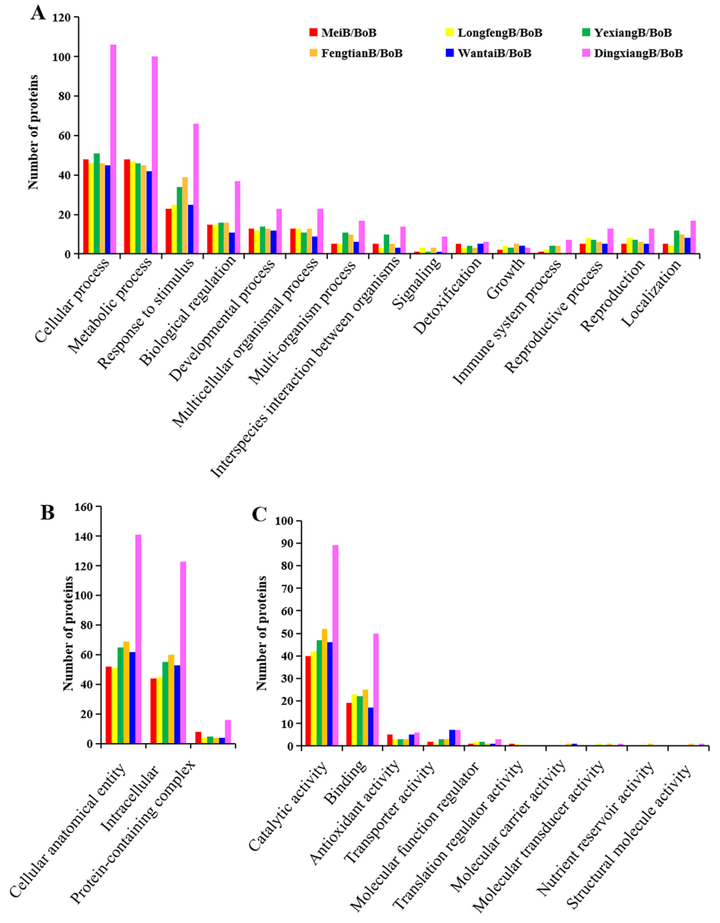
图6 通过对6个长粒品种和短粒品种的比较,针对差异表达蛋白进行了GO分析(Qing et al., 2023)。
KEGG通路富集分析显示,富集的蛋白质主要参与代谢通路、次生代谢物的生物合成和苯丙素的生物合成途径,其中有4个显著下调蛋白质(A2XTE8、B8B3X6、B8B9G7和A2WRZ6)的信号通路可能参与籽粒的长度调节(图7)。
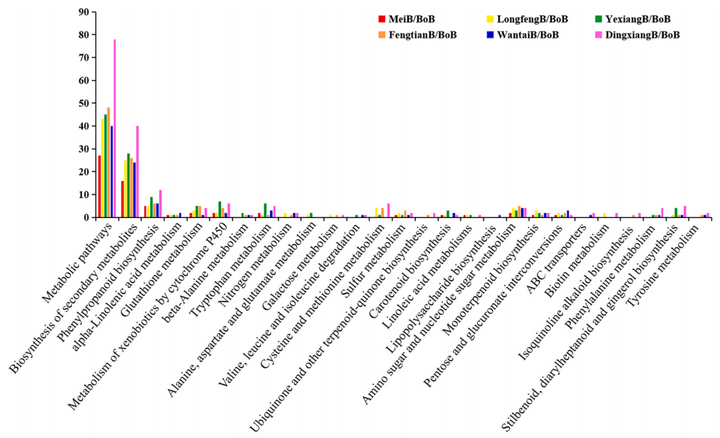
图7 6个长粒品种与短粒品种差异表达蛋白的KEGG通路分析(Qing et al., 2023)。
蛋白-蛋白互作网络分析显示9个蛋白(B8AXQ5、B8BDB0、A2YY10、A2XC22、A2YP57、B8AN72、B8AR95、B8AS84和A2X8Y7)在主要蛋白簇网络中上调,7个蛋白(B8AXE3、B8B4T1、A2YXP1、B8A7L3、A2X294、A2Y9Q8和A2YA28)在主要蛋白网络中下调,蛋白-蛋白相互作用可能在水稻籽粒大小调节中起重要作用(图8)。
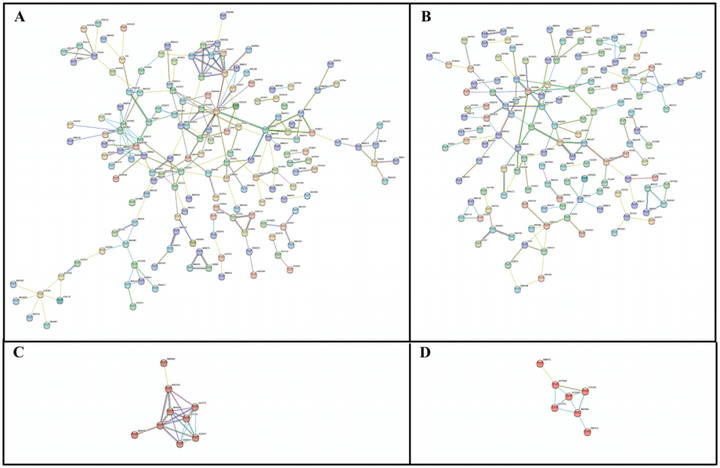
图8 利用STRING数据库对粒长调节蛋白的蛋白-蛋白相互作用网络进行分析(Qing et al., 2023)。6个长粒品种和短粒品种的上调(A)和下调(B)蛋白质互作分析。(C)过度积累蛋白中的主要MCL簇。(D)下调累积蛋白中的主要MCL簇。
伯小远将以上研究思路整理如下:
2)改善籽粒形状——籽粒大小
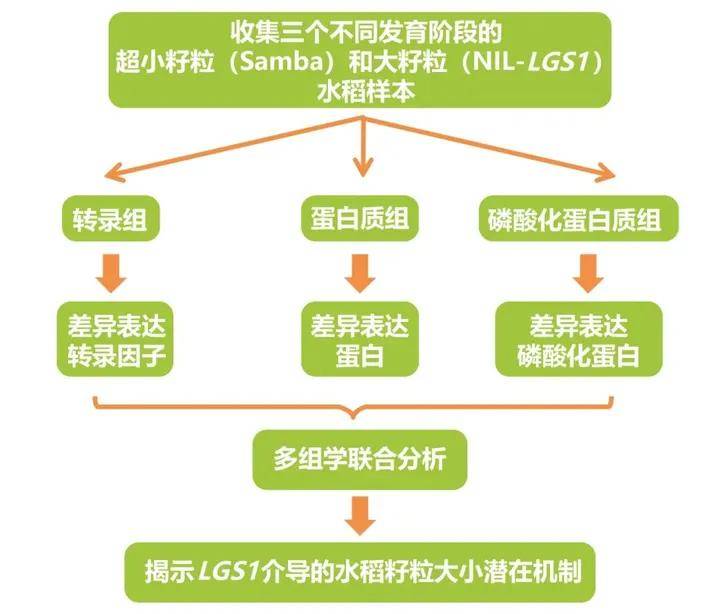
LGS1(Large grain size 1)基因,又称GS2/GL2/OsGRF4,参与调控水稻的粒级和品质,但其调控粒级的机制尚未阐明。接下来的这篇文章就是通过多组学来研究与水稻籽粒大小相关的调控网络和调控机制。
2022年,厦门大学生命科学学院黄荣裕课题组在The Crop Journal杂志上发表了题为“Transcriptomic, proteomic, and phosphoproteomic analyses reveal dynamic signaling networks influencing long-grain rice development”的研究论文,研究人员收集了Samba(超小粒的野生品种)和NIL-LGS1(大籽粒的LGS1近等位基因系)两个品种在三个不同发育阶段的水稻穗进行了转录组学、蛋白质组学和磷酸化蛋白质组学分析,以识别由LGS1介导的决定籽粒大小的内部动态功能网络。经过多组学联合分析,发现MAPK信号、钙信号、细胞增殖、细胞壁、能量代谢、激素通路、泛素-蛋白酶体通路等生物学过程可能参与LGS1介导的粒长调控。结果显示,LGS1介导的籽粒大小调节受到转录、转录后、翻译和翻译后动态变化的综合影响(Chen et al., 2022)。
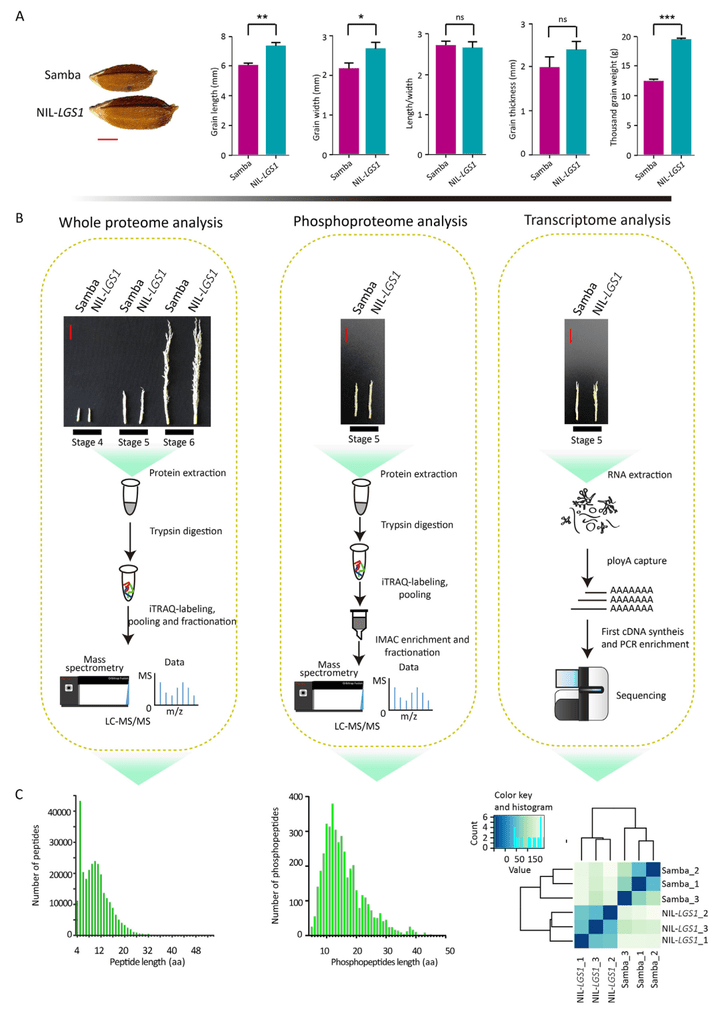
图9 本研究纳入的表型和数据类型(Chen et al., 2022)。(A)Samba和NIL-LGS1的籽粒表型。(B)蛋白质组、磷酸化蛋白质组以及转录组实验流程。(C)多组学数据的初步分析。左边和中间的两张图分别展示的是肽段长度的分布和磷酸化肽段的长度分布,右边的热图显示了Samba和NIL-LGS1生物学重复样本之间的一致聚类。
首先,差异表达蛋白共形成了7个功能高度相关的簇,多个功能簇的一致性调控可能是水稻籽粒长度发育的关键特征(图10)。
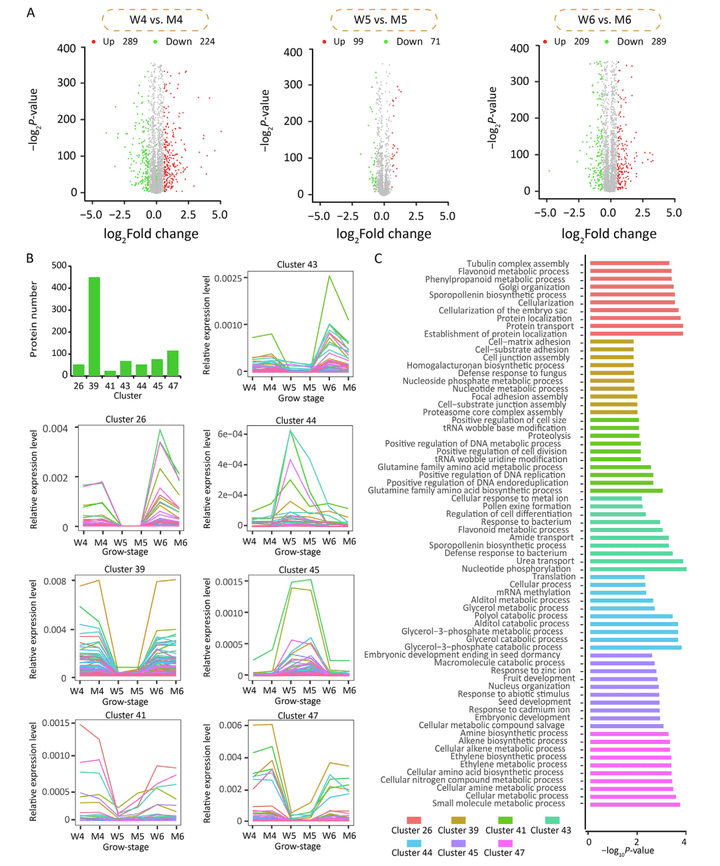
图10 差异表达蛋白的鉴定和功能富集分析(Chen et al., 2022)。(A)火山图显示了Samba和NIL-LGS1在三个不同发育阶段(阶段4、阶段5和阶段6)的差异表达蛋白。(B)7个簇的差异表达蛋白的数量和表达模式。(C)7个簇的差异表达蛋白的GO富集分析,图中仅显示每个簇的GO分类Top 10。备注:水稻幼穗的发育共包含8个阶段,即一阶段“看不见”、二阶段“苞毛现”、三阶段“毛绒绒”、四阶段“粒粒现”、五阶段“颖壳分”、六阶段“粒半长”、七阶段“穗变绿”、八阶段“穗将出”,该文章中作者选择其中的四、五、六阶段进行研究。
其次,在阶段5中,显著变化的磷酸化蛋白分别有16个显著上调和24个显著下调,磷酸化蛋白-蛋白相互作用网络在决定水稻籽粒大小中发挥辅助作用(图11)。
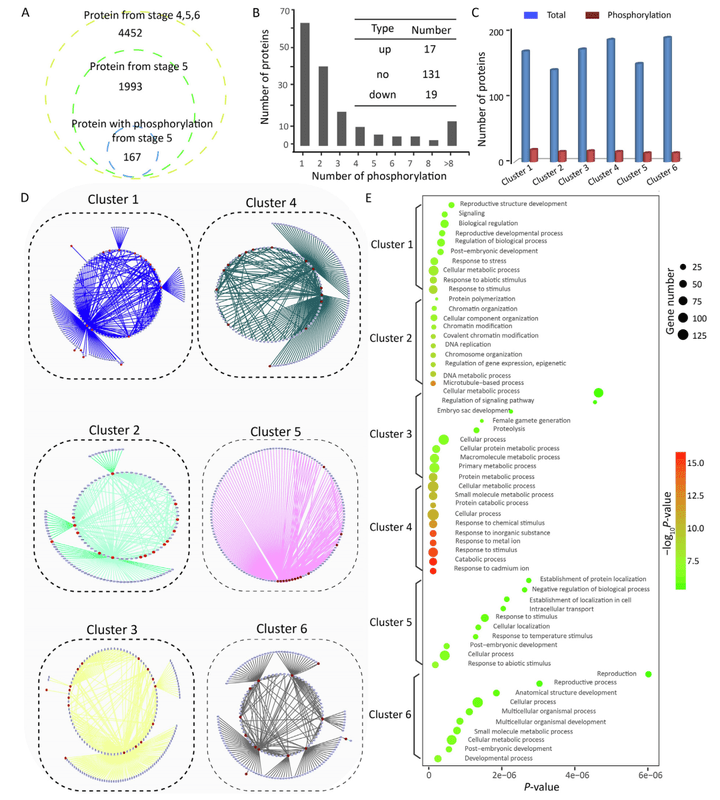
图11 磷酸化蛋白质的蛋白质-蛋白质相互作用网络(Chen et al., 2022)。(A)Samba和NIL-LGS1中总蛋白数量和磷酸化修饰蛋白的数量。其中黄色表示三个阶段的蛋白总数量,绿色表示阶段5的蛋白数量,蓝色表示阶段5的磷酸化蛋白数量。(B)每个蛋白中发生磷酸化的数量,右上角的表显示的是磷酸化差异蛋白的数量。(C)6个簇中总蛋白和磷酸化蛋白的数量。(D)6个蛋白-蛋白相互作用簇,灰色和棕色节点表示有或没有磷酸化的蛋白质。(E)通过基因本体和生物学过程对6个簇进行功能富集分析。
此外,阶段5的转录组学分析,结果发现了39个差异表达的转录因子,这些转录因子与其靶基因高度相关。GO富集分析显示显著变化的基因参与调节分子代谢、花形态的发生、花瓣发育和胚珠发育(图12)。
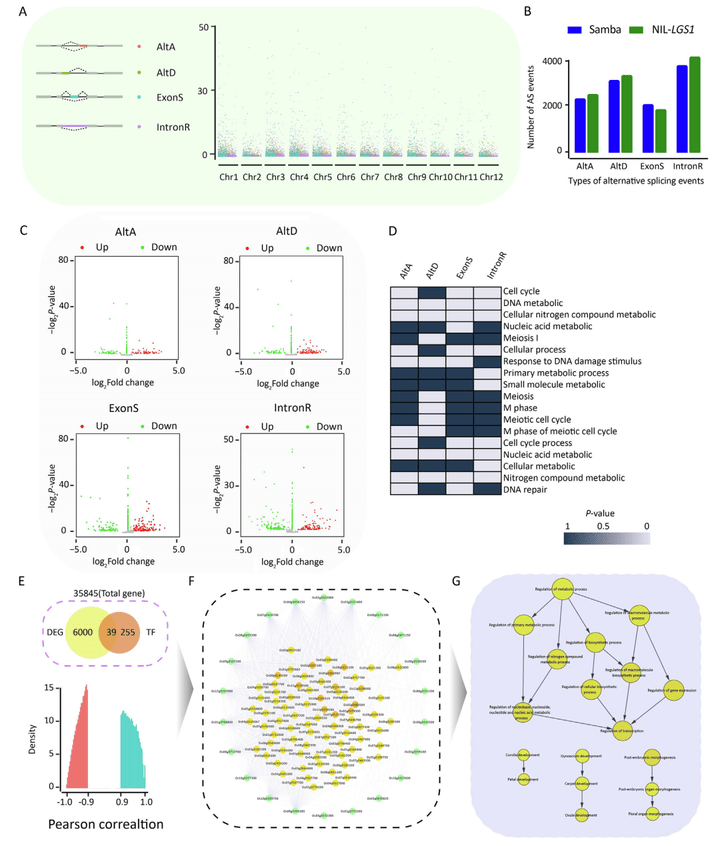
图12 转录翻译后调控和基因调控网络(Chen et al., 2022)。(A)水稻4个选择性剪切(AS)事件及其染色体分布示意图。(B)阶段5期间Samba和NIL-LGS1中AS事件的数量。(C)火山图显示了Samba和NIL-LGS1之间差异表达的AS事件。(D)热图显示了4个AS事件与生物过程相关的GO富集分析。(E)转录因子及其靶基因分析。维恩图显示了差异表达的转录因子数量,条形图表示差异表达的转录因子与其靶基因之间的相关性。(F)基因调控网络的关键子网络,绿色和黄色节点表示转录因子及其靶基因。(G)利用生物过程对子网络的基因进行GO富集分析。
多组学联合分析表明,转录水平和转录后水平的调控网络可以直接在翻译水平上进行体现,进一步分析揭示了从转录到蛋白质再到表型的调节机制(图13)。
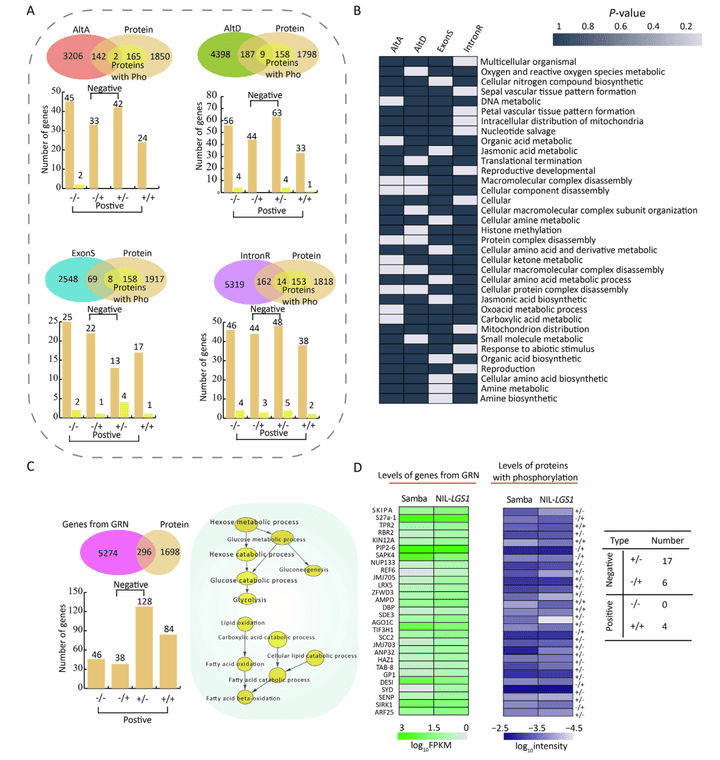
图13 利用转录组、蛋白质组和磷酸化蛋白质组对Samba和NIL-LGS1进行联合分析(Chen et al., 2022)。4个选择性剪接事件和翻译蛋白质的基因数量(A)和GO富集分析(B)。(C)基因调控网络中的基因被翻译成蛋白质的数量。(D)热图显示Samba和NIL-LGS1中变化的转录和磷酸化蛋白质,右表表示在转录水平和翻译水平之间呈现正相关或负相关的基因数量。
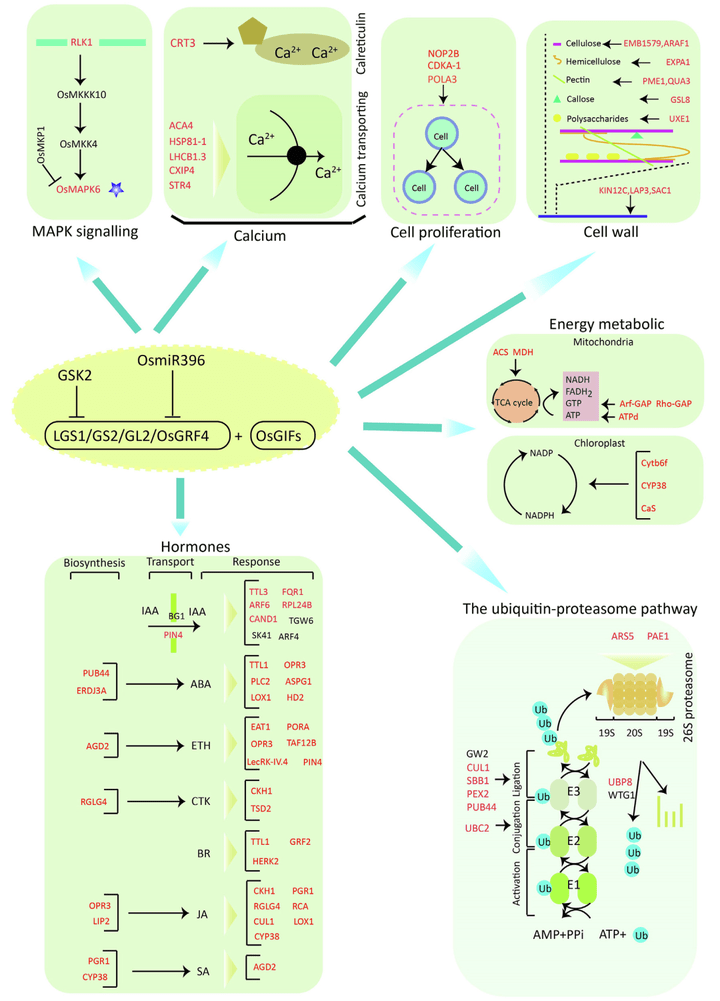
图14 LGS1介导的水稻籽粒大小潜在机制(Chen et al., 2022)。LGS1介导的粒长调控可能受到MAPK信号通路、钙信号通路、细胞增殖、细胞壁、能量代谢、激素通路、泛素-蛋白酶体通路等多个生物学过程的调控。红色和黑色标记的蛋白质分别是受LGS1影响的蛋白质和已知参与籽粒大小的蛋白质。
伯小远将以上研究思路整理如下:
3)改善籽粒形状——籽粒饱满度
籽粒灌浆是决定作物产量的主要因素之一,这一过程通常会受到非生物胁迫的影响。重度干旱会降低籽粒重量甚至导致作物死亡,而适当的干旱处理对于增强叶片光合作用、改善蔗糖转运、提高淀粉合成酶的活性及相关基因表达、增加籽粒重量和产量具有一定的促进作用。因此,识别不同水稻品种之间蛋白的表达模式差异对深入了解作物的耐旱机制具有重要意义。
2020年,中国水稻研究所陶龙兴课题组在Plant Physiology and Biochemistry杂志上发表了题为“Proteomic analysis of salicylic acid regulation of grain filling of two near-isogenic rice(Oryza sativa L.)varieties under soil drying condition”的研究论文,研究人员采用iTRAQ非标定量蛋白质组学方法,对适度土壤干旱胁迫条件下水杨酸介导籽粒灌浆的机制进行了研究。结果发现,浙富802籽粒在干旱胁迫下产量和粒重显著下降,光合相关蛋白的表达下降,而与糖酵解/TCA循环、淀粉和蔗糖代谢、抗氧化和解毒、氧化磷酸化等信号转导相关蛋白的表达显著上调。qRT-PCR验证实验显示,抑制这些显著变化的蛋白表达及相关通路,可观察到籽粒饱满度的减少。总之,本研究结果从合成生物学的角度为籽粒灌浆调控提供了新思路,为栽培实践提供了科学依据(Kimbembe et al., 2020)。
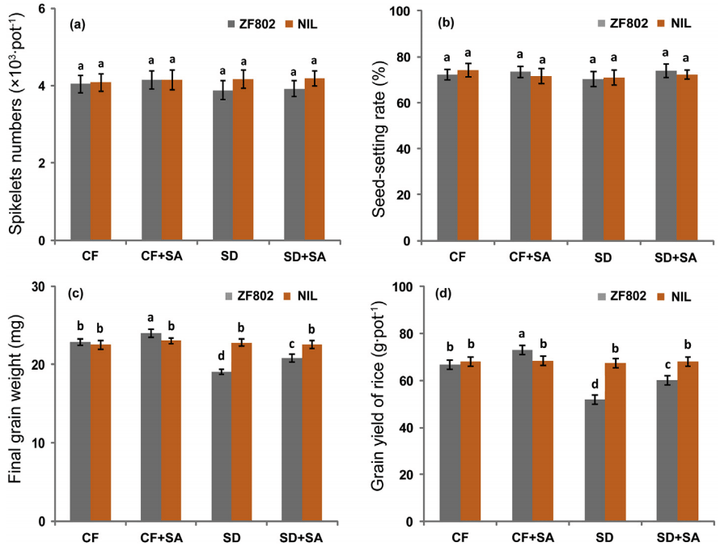
图15 土壤干燥(SD)和水杨酸(SA)不同处理下浙富802及其近等基因系(NIL)的籽粒重量和产量统计(Kimbembe et al., 2020)。(a)每株水稻的总稻穗数。(b)结实率。(c)籽粒重量。(d)产量。
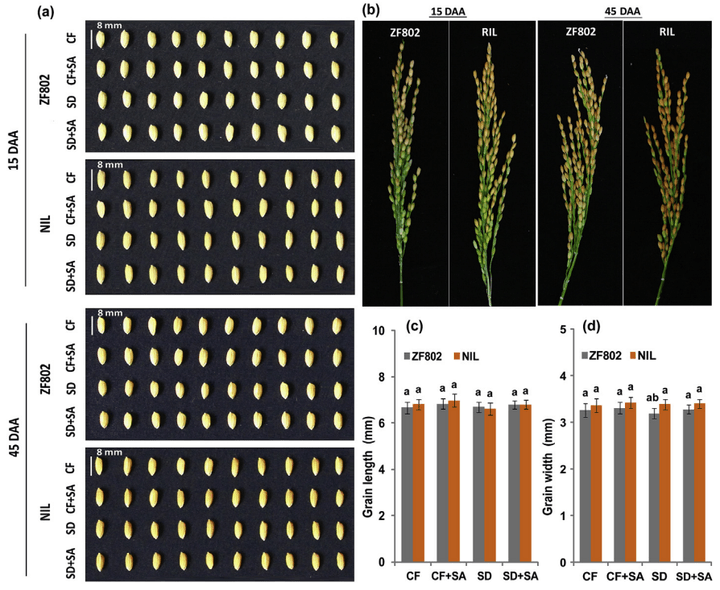
图16 土壤干旱胁迫(SD)和水杨酸(SA)处理下,浙富802 及其近等基因系(NIL)籽粒的形态(Kimbembe et al., 2020)。(a)籽粒形态。(b)水稻的花序形态。(c)籽粒长度。(d)籽粒宽度。
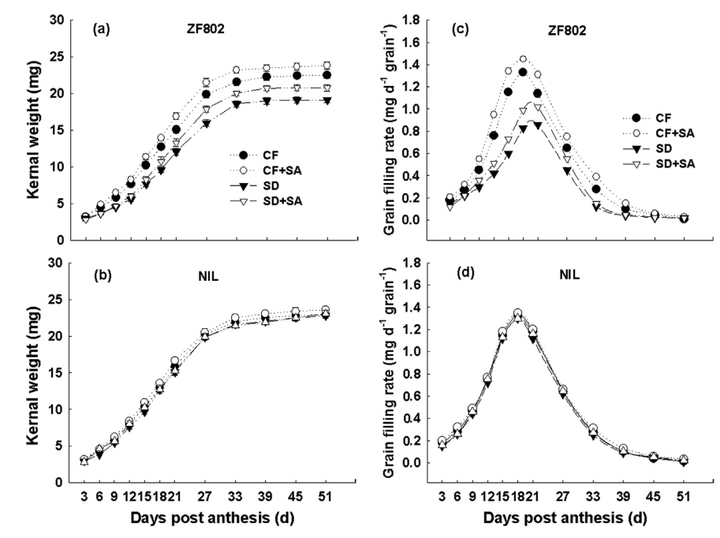
图17 土壤干旱胁迫(SD)和正常水分(CF)条件下,水杨酸(SA)处理对浙富802及其近等基因系(NIL)籽粒重量和灌浆速率的影响(Kimbembe et al., 2020)。浙富802籽粒(a)和NIL籽粒(b)内核变化情况。浙富802籽粒(c)和NIL籽粒(d)灌浆速率动态变化。结果显示,SD处理降低了普通水稻品种浙富802籽粒灌浆速率和籽粒重量。
为了确定在干旱条件下水杨酸改善水稻籽粒灌浆的机制。对不同组别中蛋白的表达水平进行了分析。这些蛋白质中有许多参与光合作用的光捕获和电子传递、氧化磷酸化、光呼吸、氧化还原反应中的质子运输、ATP合成以及分子结合和聚合,以维持细胞骨架的完整性(图18)。
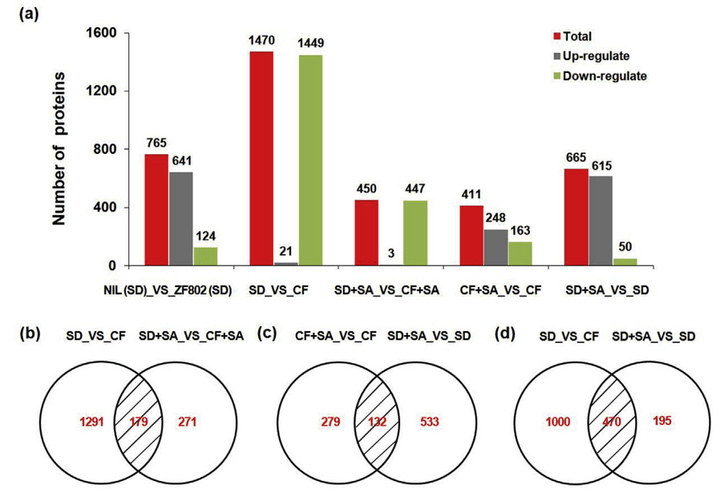
图18 不同比较组间(a-d)表达水平有统计学差异的蛋白质在水稻籽粒中的分布(Kimbembe et al., 2020)。结果显示,在765个差异表达蛋白中,与浙富802(SD)相比,NIL(SD)中有641个蛋白显著上调,124个蛋白显著下调。
富集分析结果显示,在光合作用富集途径中,从光敏色素的积累、酶催化和电子传递驱动的光反应,到碳固定、光呼吸、叶绿素合成等,蛋白质的表达水平都发生了显著的变化(图19)。
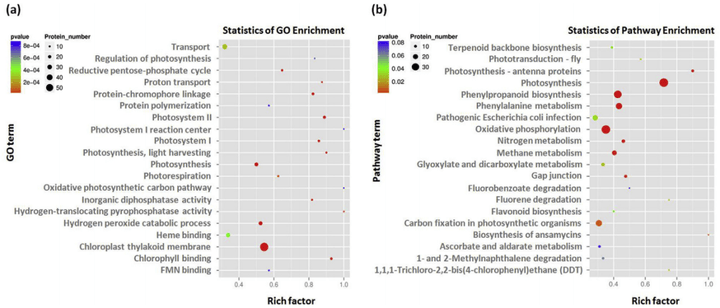
图19 浙富802及其近等基因系(NIL)差异表达蛋白富集分析(Kimbembe et al., 2020)。(a)差异表达蛋白的GO富集分析。(b)差异表达蛋白的KEGG途径富集分析。
伯小远将以上研究思路整理如下:
小远叨叨
如何提高作物产量是育种方面需要重点考虑的问题,今天小远给大家介绍了蛋白质组学在改善籽粒形状(比如“籽粒长度”、“籽粒大小”和“籽粒饱满度”)提高作物产量方面的应用。蛋白质在执行生理功能时具有多样性、动态性的特点,需要多个蛋白的参与从而正确的行使生物学功能,所以需要在整个网络水平上研究蛋白质。相对于核酸而言蛋白质更为复杂,但正是这些特性影响整个生命活动过程,所以蛋白质组学的研究更有意义。从鉴定蛋白质组学、定量蛋白质组学到修饰蛋白质组学所涉及的技术服务伯远生物均可以提供,如果各位老师有蛋白质组学方面的研究需求,可随时联系我们喔!
References:
Swinbanks D. Government backs proteome proposal[J]. Nature, 1995, 378: 653.
Meichao J I, Bin F U, Yangjun Z. Recent progress of analytical methods of proteomics based on mass spectrometry[J]. Journal of Chinese Mass Spectrometry Society, 2021, 42(5): 862.
Mergner J, Kuster B. Plant proteome dynamics[J]. Annual Review of Plant Biology, 2022, 73: 67-92.
Tan B C, Lim Y S, Lau S E. Proteomics in commercial crops: An overview[J]. Journal of proteomics, 2017, 169: 176-188.
Qing D, Zhou Y, Pan Y, et al. TMT-based quantitative proteomic analysis of indica rice cultivars reveals that novel components of the signaling pathways might play a role in grain length regulation[J]. Journal of Proteomics, 2023, 270: 104745.
Chen F, Wang Y, Zhang Z, et al. Transcriptomic, proteomic, and phosphoproteomic analyses reveal dynamic signaling networks influencing long-grain rice development[J]. The Crop Journal, 2022, 10(3): 716-728.
Kimbembe R E R, Li G, Fu G, et al. Proteomic analysis of salicylic acid regulation of grain filling of two near-isogenic rice (Oryza sativa L.) varieties under soil drying condition[J]. Plant physiology and biochemistry, 2020, 151: 659-672.
NO.1伯远生物近期上新、优惠Recent promotions
【限时特惠】西瓜遗传转化
【限时特惠】杨树遗传转化
【业务介绍】酵母文库构建
【伯远严选】泰裤辣!
【科研绘图】伯远生物业务介绍
NO.2好文推荐Historical articles
【文献分享】蛋白质组学如何研究植物昼夜节律?
【文献分享】植物蛋白质组学,如何发“10分+”的文章?
【文献分享】TMT蛋白质组学:解析藜麦种子成熟机制
磷酸化在植物应对胁迫以及生长发育中的作用
NO.3伯远生物可以提供以下技术服务Commercial services
表观组学服务
蛋白质组学服务
载体构建服务
二十二大物种遗传转化服务
各物种基因编辑全套服务
各种分子检测服务
蛋白-蛋白、蛋白-核酸相互作用筛选及验证
伯远严选试剂商城-伯远严选,为你而选!
伯远工程-提供高品质实验平台搭建及配套的专业实验设备