端午节+儿童节,假期到了,不知道大家有没有安排出游,去哪里放松、吃到什么特别的美食?长大之后,儿童节就悄悄地从我们的生活中“毕业”了,忙碌中偶尔的童心和好奇,还是要有的。
今天分享最近学习的 Nature 重磅新作,来自张泽民院士团队,提出了一个非常有意思的新概念:跨组织细胞模块(CM)。
在单细胞测序领域,张泽民院士团队一直走在国际前沿。他们此前在Cell、Science等顶刊发表了T细胞、NK细胞、B细胞和髓系细胞的泛癌单细胞图谱,系统描绘了免疫细胞在多种肿瘤中的异质性。这些研究奠定了肿瘤免疫微环境的细胞基础,也确立了团队在单细胞图谱领域的重要地位。

此次他们于2025年发表在Nature的最新成果 Cross-tissue multicellular coordination and its rewiring in cancer,则换了一个全新视角:不再局限于某一细胞类型,而是聚焦跨组织的多细胞协同。这项研究提出了“细胞模块(cellular module, CM)” 的新概念和分析框架CoVarNet,去探索人体不同组织中细胞如何组团合作,以及癌症如何打乱这种“团队合作”。这种从系统层面理解细胞合作的思路在单细胞领域尚属首次,意义非凡。
文章内容深度和信息量都非常大,是值得反复学习的经典之一。为了更好地理解这项工作的核心思路,本文尝试先梳理出作者的研究逻辑和关键观点,对每张Figure的设计思路和数据支撑也进行了详细拆解。
关于其中涉及的算法细节(如CoVarNet)、空间验证方式等,后续将持续学习和整理。
👋 欢迎关注我的生信学习专栏~ 如果觉得文章有帮助,别忘了点赞、关注、评论,一起学习
一、 研究背景与价值
- 人体由约 37 万亿个细胞组成,不同细胞在组织微环境中协同维持稳态,但跨组织的高阶协同机制尚不清晰;肿瘤进程中这种网络可能被重塑,制约诊疗策略的开发 。
- 单细胞技术与 Human Cell Atlas 的进展为系统揭示多细胞协同提供了可能,但现有工作多聚焦单一组织或依赖配体-受体分析,难以还原全局组织单元 。
- 因此,作者提出在全身尺度系统鉴定“跨组织细胞模块(cellular modules, CMs)”,并评估其在癌症中的“重连”(rewiring)意义。
二、 研究整体行文思路
-
构建全身单细胞图谱
- 汇集 35 种健康组织706 样本,获得 2,293,951 细胞并注释为 76 个非上皮细胞子集 。
-
提出 CoVarNet 算法
- 基于子集丰度协方差,采用 NMF + 特异相关双模块识别共现网络,定义 12 个跨组织 CMs 。
-
空间与表型验证
- 结合 Visium/Xenium 空间转录组和体内扰动数据,确认 CMs 的共定位及细胞间通讯特征 。
- 将 CMs 活性与年龄(脾脏)、绝经(乳腺)等人体表型关联,描绘时空动态轨迹 。
-
扩展至泛癌图谱
- 整合 29 癌种1,062 临床样本(≈3 百 万细胞),训练 Transformer-基参考模型,识别 91 个子集(含 15 癌症相关亚群) 。
- 在 8 个有匹配健康-邻癌-肿瘤样本的癌种中,量化健康 CMs 与癌症-CMs(cCMs)的动态,特别是癌泛化 cCM02 。
三、 主要发现与结论
| 维度 | 关键结果 |
|---|---|
| 跨组织协同单元 | 发现 12 个 CMs,按器官系统呈特异富集;例如 CM01 为“普适巨噬-成纤维-淋巴管”骨架,CM08 为皮肤/黏膜免疫屏障 。 |
| 空间-通讯特点 | CMs 内细胞在组织切片中显著共定位,高淋巴细胞占比 CMs(如 CM05)空间集中且依赖近距离通讯;含基质/内皮细胞的 CMs 则分泌更丰富的远距信号 。 |
| 脾脏衰老 | CM05(B 细胞-Treg-NK)随年龄上升而增强,CM06(幼稚 T/B 细胞)下降,说明免疫老化呈模块化协调;共轭转录因子(JUN/FOS/NK-κB 等)活性同步升高 。 |
| 乳腺绝经轨迹 | 乳腺特异 CM12 的三类成纤维细胞(S06/S09/S10)在绝经后显著减少且炎症评分下降,构成“绝经-基质重塑”渐变轴,可被外部队列复现 。 |
| 肿瘤重连 | 肿瘤样本普遍表现为健康 CMs 活性丧失 + cCM02(肿瘤相关免疫-基质亚群共生单元)活性递增;cCM02 在健康→邻癌→肿瘤阶段连续增强,与干扰素-IL-18-IL-15 轴和 S100A8/9-MCP 上调关联,可预测肺前驱病变进展 。 |
综合结论
人体组织以可复用的多细胞模块为基本单元维系功能;衰老、内分泌变迁及肿瘤发生均通过“增减或重连”这些模块实现表型转变。该工作为跨组织-跨疾病尺度理解微环境提供了系统框架。
以下是各Figure的详细解读,每一张图结合文中数据和作者结论
Figure 1|A single-cell atlas of the human
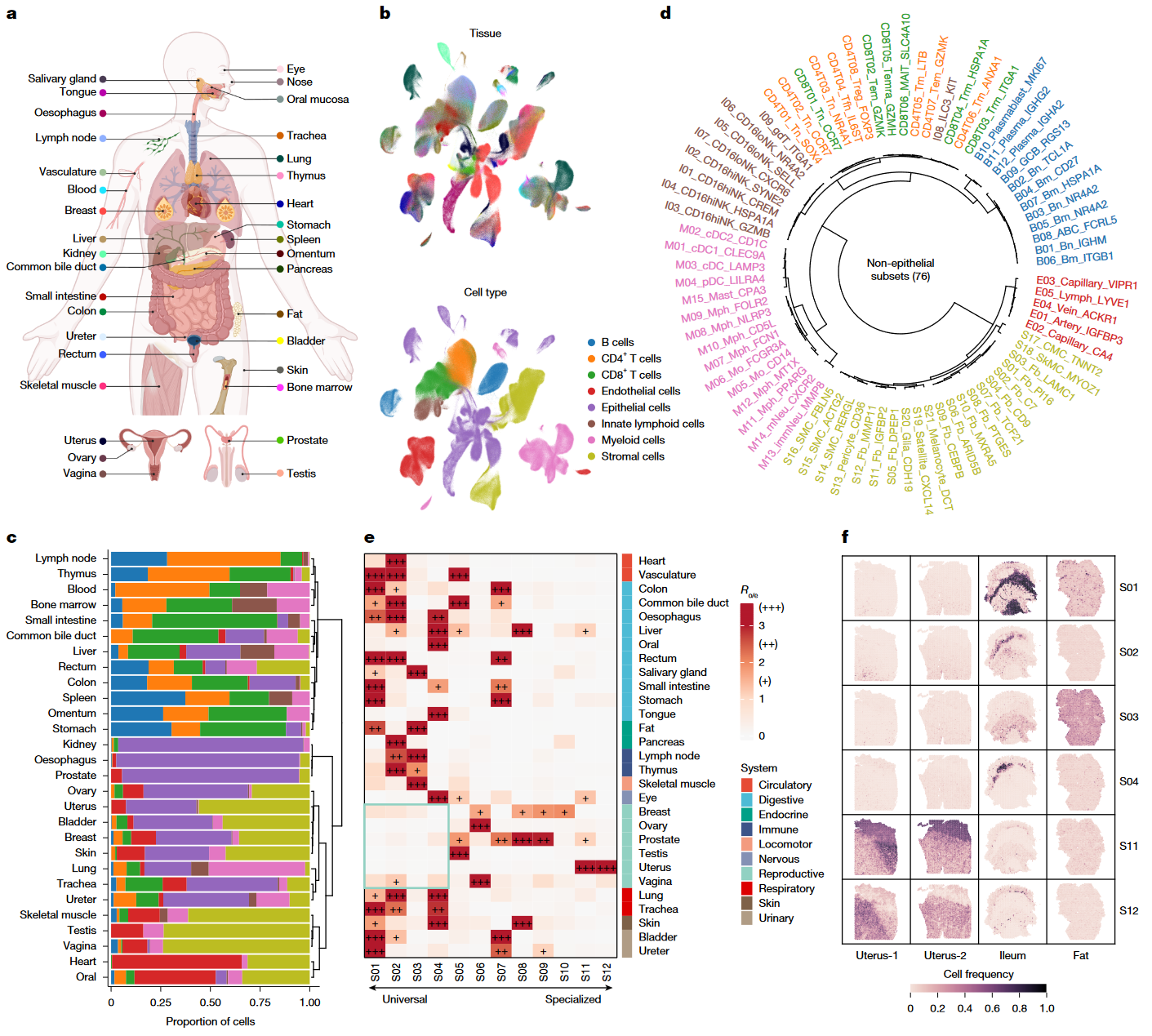
| 小图 | 数据/分析 | 支撑的作者结论 |
|---|---|---|
| a | 汇集 35 种组织 706 例样本 2,293,951 细胞的整合 UMAP,可见各组织免疫/基质/实质细胞清晰分区。 | 全身组织细胞组成高度异质,需要系统整合才能比较。 |
| b | 依赖 BBKNN 对批次校正评测(scIB benchmark),选出最佳整合方案。 | 证明 atlas 的整合质量足以做跨队列协方差分析。 |
| c–d | 188 个细胞亚群的丰度矩阵 → CoVarNet NMF 因子分解 → 共现网络 → 12 个 cross-tissue CMs。 | 首次提出“跨组织细胞模块(CM)”这一功能单元概念。 |
| e | 各 CM 在 35 个组织的丰度热图,呈现明显器官偏好。 | 细胞模块既跨组织复用,又带组织嵌套特征。 |
| f | 每个 CM 内细胞-细胞 Pearson 相关矩阵示例,相关性特异 & 紧密。 | 佐证模块内细胞是真正协同而非偶然同现。 |
核心观点:健康人体存在 12 个可复用、功能互补的跨组织细胞模块,为后续动态研究奠定框架。
Figure 2|Systematic identification of cross-tissue CMs
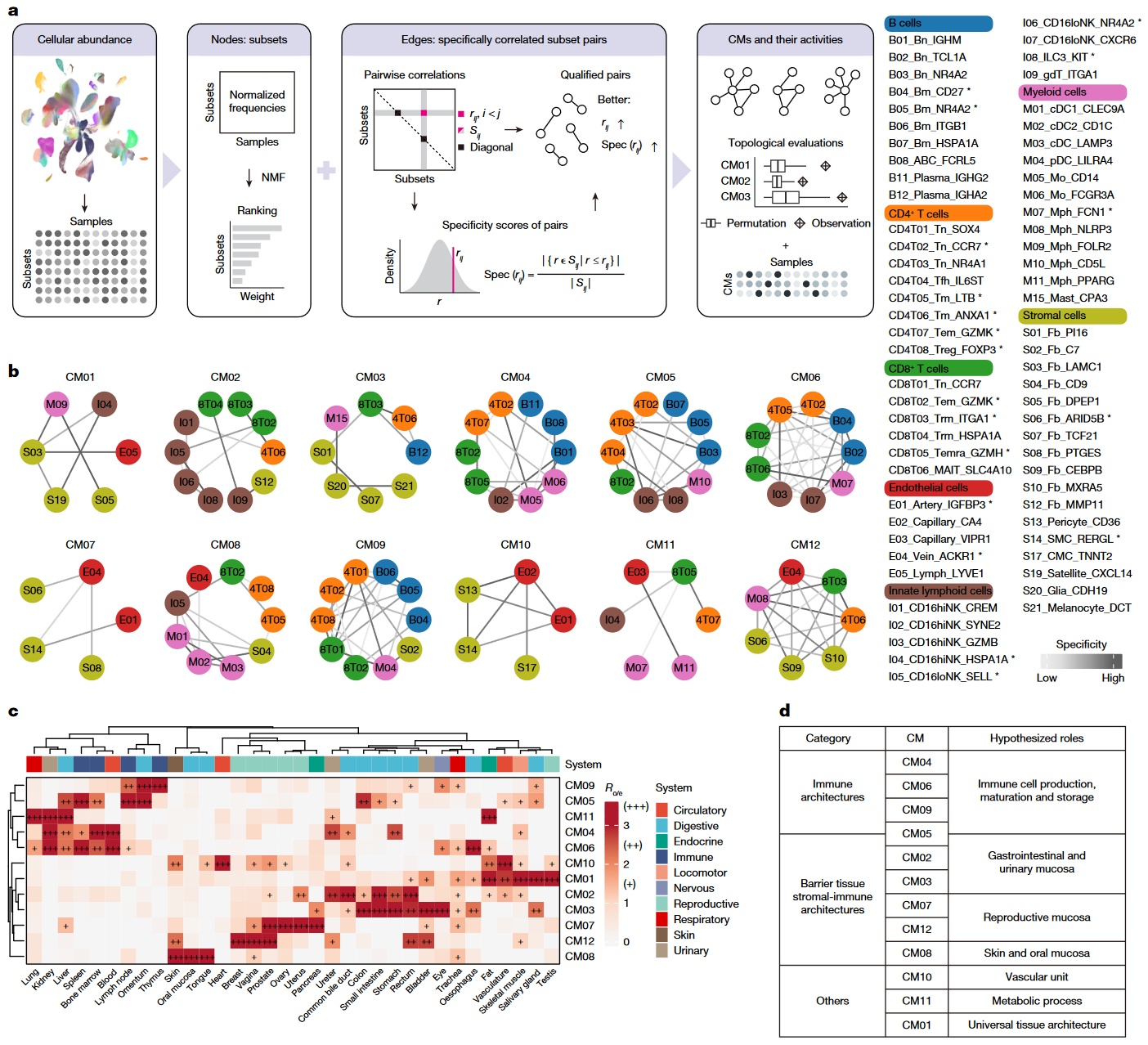
| 小图 | 数据/分析 | 结论逻辑 |
|---|---|---|
| a–b | 每个 CM 细胞组合饼图 + 细胞-功能字典,显示 CM01 以驻留巨噬-成纤维-淋巴管为骨架,CM08 富含黏膜屏障免疫细胞。 | CM 的功能互补性与器官生理吻合。 |
| c | CM 在各器官的“富集轨迹”雷达图,展现组织偏好。 | 不同 CM 在不同器官承担专责任务。 |
| d–f | 配体-受体对与空间共定位指数:淋巴细胞富集 CM 空间聚集而远距信号少;基质型 CM 相反。 | 功能-空间双重特征证明 CM 是真实生态单元。 |
核心观点:CM 具有“功能互补 + 组织嵌套 + 通讯特异”三大标志,是理解组织稳态的基本框架。
Figure 3|Spatially resolved multicellular coordination in CMs
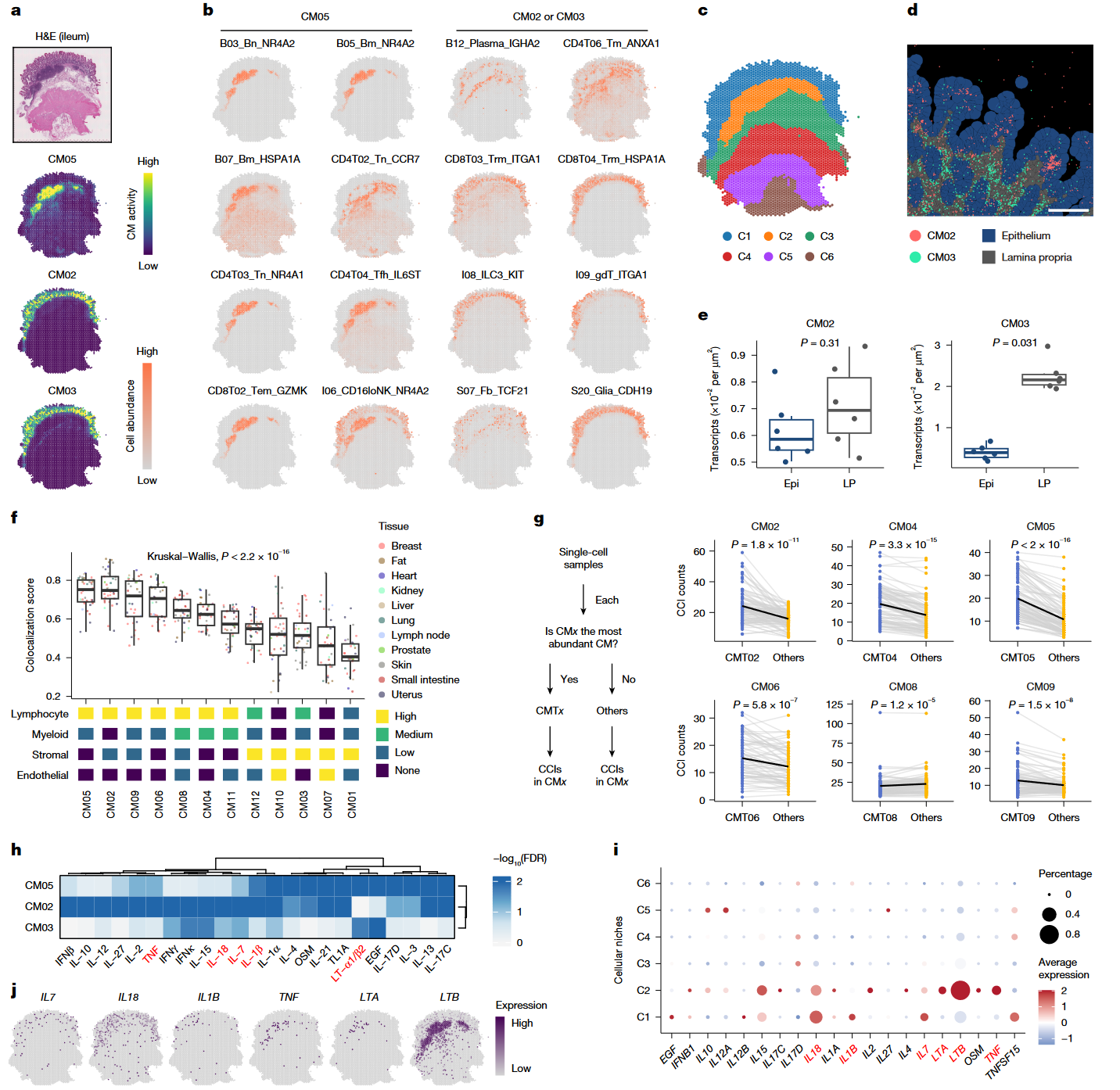
| 小图 | 数据/分析 | 结论逻辑 |
|---|---|---|
| a–c | Visium/Xenium 把 CM02/CM03 分别映射到小肠派伊氏结与固有层,展示空间互补。 | 单体空间技术难区分的黏膜免疫亚区被 CM 精细拆分。 |
| d–g | 小肠 C1 区富集 IL7/IL18,C2 区富集 LTA/LTB;体内扰动验证 CD8T02 对 TNF 反应仅限 CM02/08/09。 | CM 决定同种细胞对细胞因子的响应差异——“同细胞、不同团队、不同职责”。 |
| h–j | 腺样组织 (breast) CM12 的三类成纤维细胞 S06/S09/S10 随更年期沿 PHATE 轨迹同步下降,并伴炎症评分降低。 | CM12 捕捉到绝经相关组织重塑的“细胞生态轨迹”。 |
核心观点:CM 框架能在空间层面复原免疫/基质亚区,并解析生理转变(绝经)的时空协同动态。
Figure 4|Multicellular dynamics in context(衰老 & 绝经)
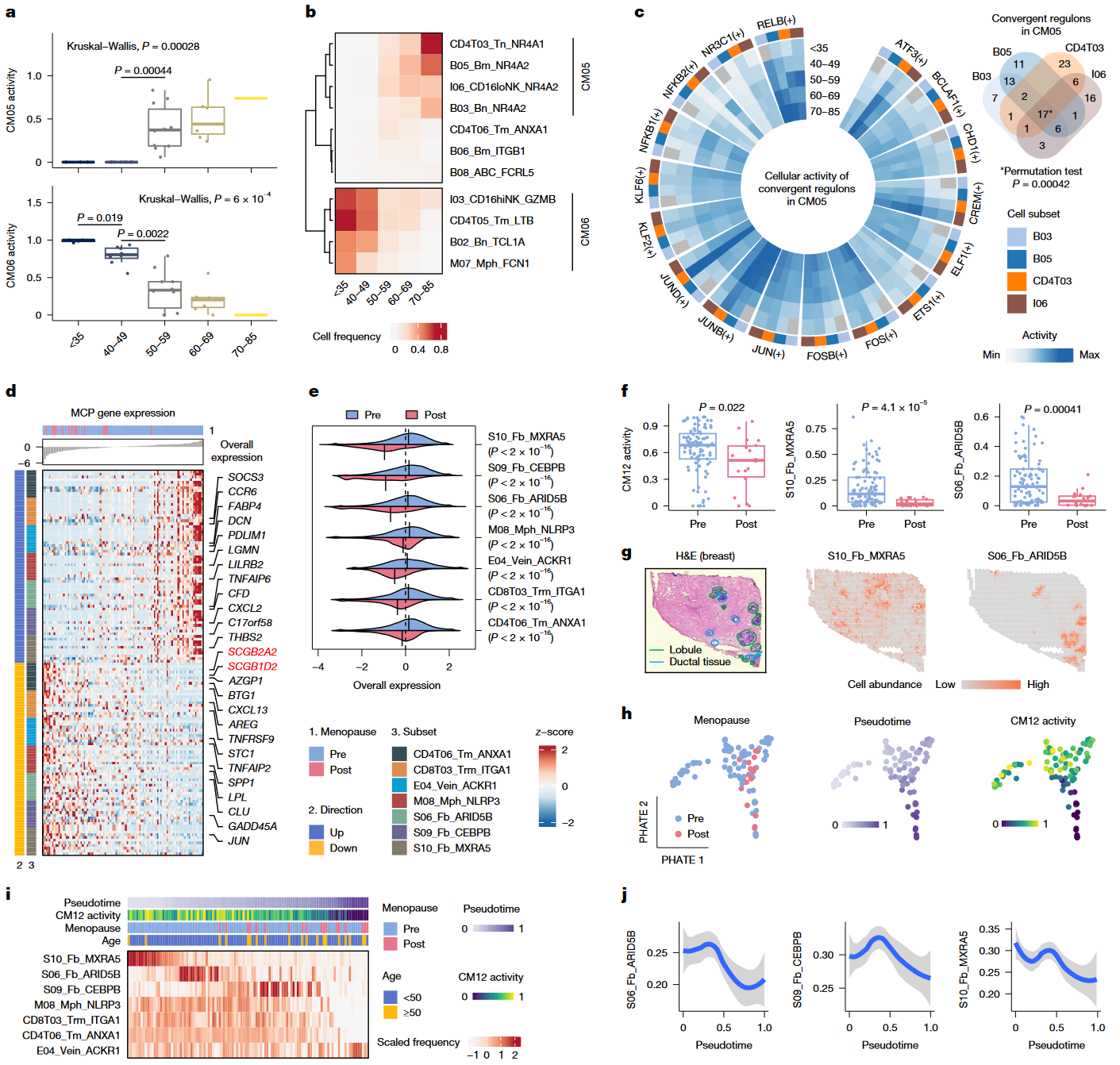
| 小图 | 数据/分析 | 结论逻辑 |
|---|---|---|
| a–c | 在脾脏,CM05 活性随年龄上升、CM06 下降;17 个共同转录因子在 CM05 随龄激活。 | 免疫衰老是多细胞模块化事件,而非孤立细胞变化。 |
| d–f | 乳腺 CM12 解析更年期轨迹:CM12 活性与 S10/S06 纤维细胞频率在绝经后显著降低。 | 特定多细胞模块的重塑呈绝经特异而非纯年龄现象。 |
| g–j | Visium 验证 S10/S06 在乳腺导管区共定位;PHATE 显示从“活跃炎症纤维-Pre”走向“低炎症-Post”路径。 | 绝经导致纤维细胞生态由炎症型转向静息型。 |
核心观点:衰老和绝经可被量化为跨细胞-跨组织模块的协同增减与转录调控收敛。
Figure 5|Rewiring of multicellular ecosystems in cancer
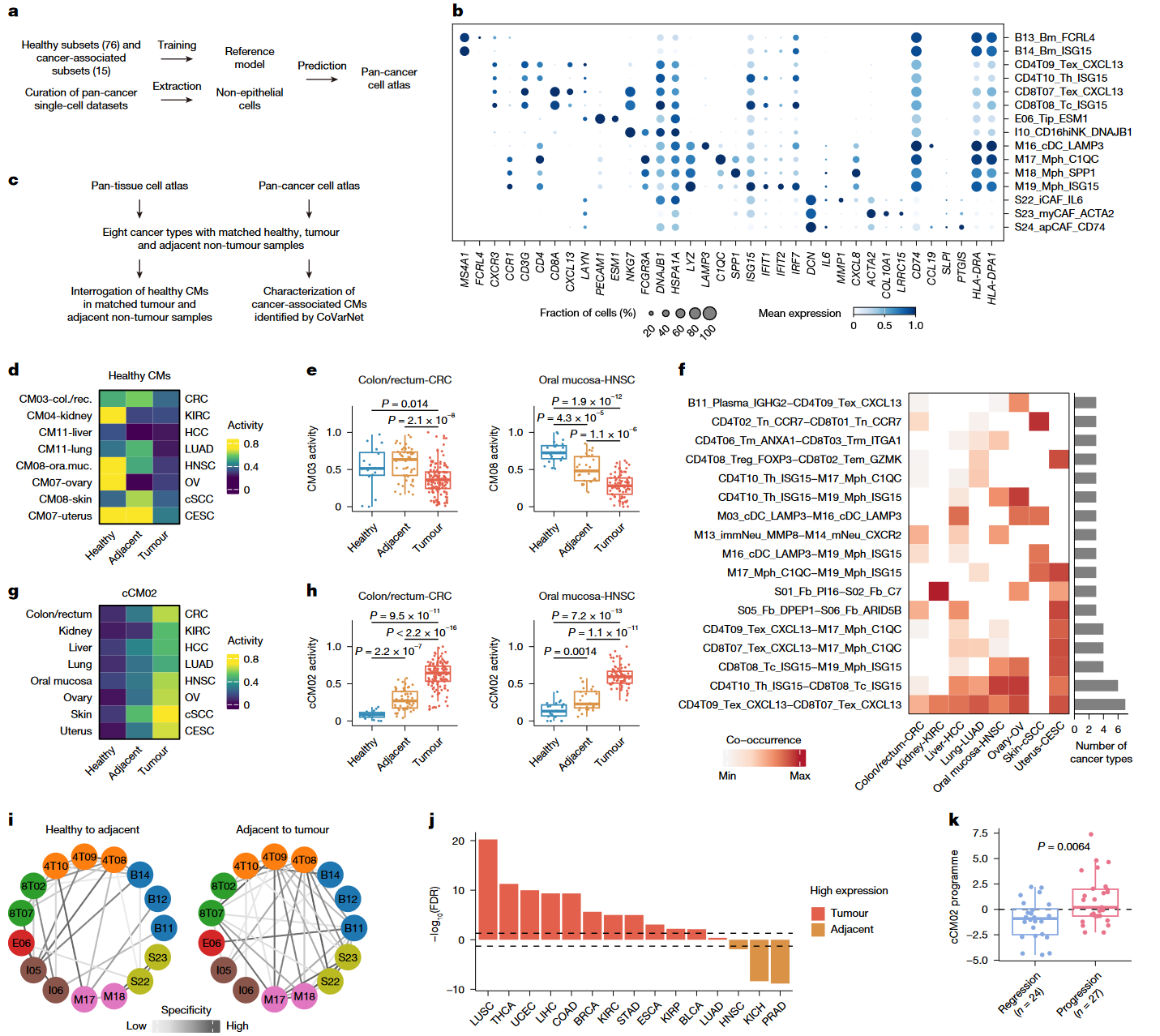
| 小图 | 数据/分析 | 结论逻辑 |
|---|---|---|
| a–c | 构建 29 癌种 > 3 百万细胞 pan-cancer atlas;TOSICA Transformer 注释 91 个子集。 | 大尺度跨癌资源为后续 cCM 分析奠基。 |
| d–e | 8 癌种健康-邻癌-肿瘤三阶段:多数健康 CM 在肿瘤下降,少数如皮肤 CM08 例外。 | 组织特异 CM 广泛受损,解释多癌种免疫屏障失效。 |
| f–h | Co-occurrence 热图识别肿瘤共线细胞对;CoVarNet 找到 4 个 cCM,其中 cCM02 富含促肿瘤免疫-基质细胞,活性从健康 → 邻癌 → 肿瘤递增。 | 提出“健康组织协同瓦解 + 癌症生态趋同”的双轨模型。 |
| i–k | cCM02 内细胞-细胞网络在肿瘤中边数激增;S100A8/9-MCP 程序上调且可预测肺前驱病变进展。 | cCM02 是癌症阶段递增、可早期预警、跨癌共享的“收敛微环境”。 |
核心观点:癌症通过“剪断”健康组织特有模块、并“拼装”一个跨癌共享的抑制性 cCM02,从系统层面实现免疫逃逸与促进进展。
✎ 逻辑总述
- Figure 1–2 先用 CoVarNet 在巨量健康数据中定义 12 个跨组织细胞模块,并证实其空间-功能真实性。
- Figure 3–4 依次探讨模块在空间、衰老、绝经情境下的动态协调,指出“模块化增减 + 共调控因子激活”是生理变迁规律。
- Figure 5 将框架扩展到 29 癌种,揭示“组织特异模块瓦解 + 癌共性模块收敛”的肿瘤演化普适机制,并验证 cCM02 的诊断-预后潜力。
该链式逻辑完成了从发现模块 → 解析调控 → 连接疾病的完整闭环。
四、 技术与概念创新
- CoVarNet 算法:首个基于“共现-特异相关”解析跨组织多细胞网络的通用工具,避免仅依赖空间邻近或配体-受体假设 。
- 双尺度单细胞资源:构建迄今最大规模 pan-tissue 与 pan-cancer 单细胞图谱,并公开数据/代码与可视化平台。
- 表型-模块耦合分析:将年龄、绝经及多癌种进展映射到 CM 活性与空间动态,揭示模块化稳态与病理重塑的一般规律 。
- 癌症“生态系统双轨模型”:提出“健康组织特异模块丧失 + 癌共性模块收敛”并存的肿瘤演化观,提供多癌种共享治疗靶点线索 。
五、前景
- 当前框架整合上皮细胞、胞外基质和微生物组;未来可能纳入多组学-多模态数据以完善生态结构 。
- 将 CM 网络扩大人群与疾病谱,可推动精准干预策略开发。
这篇 Nature 新作,是张泽民院士团队继多个单细胞图谱之后,在“系统性免疫生态”研究方向上的一次关键探索。文章提出的跨组织细胞模块(Cross-tissue Cell Modules, CMs) 概念,不再局限于单一器官或某类细胞亚群,而是以系统协调的视角,从个体层面描绘出免疫细胞如何在不同组织中协同构建稳态与功能。这不仅丰富了我们对健康免疫系统的理解,也为解析疾病(特别是肿瘤)中的多细胞重塑,提供了全新的研究框架。
文章背后的研究理念,代表着组学研究从“细胞图谱构建”逐步迈向“细胞系统逻辑建模”的过渡阶段。未来或许会有更多关于细胞间协同、系统性变化和个体层面调控机制的研究涌现,逐步走向精准解码疾病微环境的道路。
本文为初步梳理,许多细节与分析仍值得深入学习。后续有时间也将持续追踪该系列工作,围绕 CoVarNet 方法、空间验证技术、多癌种泛化等问题做进一步理解与分享,欢迎关注,共同进步。
👋 欢迎关注我的生信学习专栏~ 如果觉得文章有帮助,别忘了点赞、关注、评论,一起学习