1
猪痢疾
猪痢疾(swine dysentery)曾称为血痢、黏液出血性下痢或弧菌性痢疾,现称为猪痢疾,是由致病性猪痢疾短螺旋体引起的猪的一种肠道传染病。其特征为黏液性或黏液出血性下痢,大肠黏膜发生卡他性出血性炎症,有的发展为纤维素性坏死性炎症。
Whiting在1921年首次报道本病,1971年才确定其病原体为猪痢疾短螺旋体,目前本病已遍及全世界主要的养猪国家。我国于1978年由美国进口种猪发现本病,上海市农业科学院畜牧兽医研究所经临诊观察、粪便及大肠黏膜检查、病原分离培养、动物接种等确诊为猪痢疾。20世纪80年代后,疫情迅速扩大,涉及全国20多个省市,由于采取综合防制措施,20世纪90年代后本病得到有效控制。目前仍有散在发生。
一、病原
本病的病原体为猪痢疾短螺旋体,曾命名为猪痢疾密螺旋体、猪痢疾蛇形螺旋体,存在于猪的病变肠段黏膜、肠内容物及粪便中。短螺施体有4-6个弯曲,两端尖锐,呈缓慢旋转的螺丝线状。在暗视野显微镜下较活泼、以长轴为中心旋转运动。在电子显微镜下可见细胞壁与外膜之间有7-9条轴丝。革兰氏染色阴性,苯胺染料或姬姆萨染液着色良好,组织切片以镀银染色更好。
本菌为严格厌氧菌,对培养基要求严格,一般常用胰胨大豆鲜血琼脂或胰胨大豆汤培养基。在1.103×105Pa、80%H2(或无氧N2)。20%CO2以钯为催化剂的厌氧罐内,于37~42℃培养6d,在鲜血琼脂上可见明显的β型溶血,在溶面带的边缘,有云雾状薄层生长物或针尖状透明菌落。试验证明,猪痢疾短螺旋体在结肠、盲肠的致病性不依赖于其他微生物,但肠内固有厌氧微生物可协助本菌定居和导致病理变化严重。本菌菌体含有两种抗原成分:一种为蛋白质抗原,为种特异性抗原,可与猪痢疾短螺旋体的抗体发生沉淀反应,而不与其他动物短螺旋体抗体发生反应;另一种为脂多糖(LPS)抗原,是型特异性抗原。Hampson等对北美、欧洲和澳大利亚B.h菌株的LPS进行了研究,将LPS分为9个血清群(A~I),每群含有几个不同血清型。到目前为止,未见B.h血清型之间有毒力差异的报道。
痢疾短螺旋体对外界环境抵抗力较强,在粪便中5℃存活61d,25℃存活7d,在土壤中4℃能存活102d,-80℃存活10年以上。对消毒剂抵抗力不强,普通浓度的过氧乙酸、来苏儿和氢氧化钠均能迅速将其杀死。

图1 急性死亡病例,大肠内充血、水肿,大肠内充满番茄样内容物
二、流行病学
猪痢疾仅引起猪发病。各种年龄和不同品种猪均易感,但7~12周龄的猪发生较多。小猪的发病率和病死率比大猪高。一般发病率约75%,病死率5%~25%。
病猪或带菌猪是主要传染源,康复猪带菌可长达数月,经常从粪便中排出大量菌体,污染周围环境、饲料、饮水,或由饲养员、用具、运输工具的携带,经消化道而传播。运输、拥挤、寒冷、过热或环境卫生不良等都是本病发生的诱因。
犬、鸟经口感染后13d和8h在粪便中仍有菌体排出。苍蝇至少带菌4h,小鼠为100多天。不少国家报道,猪痢疾流行原因是引进带菌猪所致。但也见于没有购入新猪历史的猪群,可能与上述传播媒介引起有关。
本病无明显季节性,流行经过比较缓慢,持续时间较长,且可反复发病。本病往往先在一个猪舍开始发生几头,以后逐渐蔓延开来。在较大的猪群流行时,常常拖延达几个月,而且很难根除。
三、临床症状
潜伏期3d至2个月以上,自然感染多为1~2周。
急性型往往先有个别猪突然死亡,随后出现病猪,病初精神稍差,食欲减少,粪便变软,表面附有条状黏液。以后迅速下痢,粪便黄色柔软或水样。重病例在1~2d间粪便充满血液和黏液。在出现下痢的同时,腹痛,体温稍高,维持数天,以后下降至常温,死前体温降至常温以下。随着病程的发展,病猪精神沉郁,体重减轻,渴欲增加,粪便恶臭带有血液、黏液和坏死上皮组织碎片。病猪迅速消瘦,弓腰缩腹,起立无力,极度衰弱,最后死亡。病程约1周。
慢性病例病情较轻。下痢,黏液及坏死组织碎片较多,血液较少,病期较长。进行性消瘦,生长迟滞。不少病例能自然康复,但间隔一定时间,部分病例可能复发甚至死亡。病程为1个月以上。
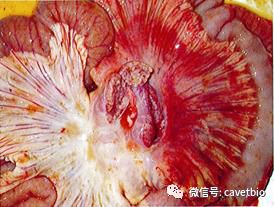
图2肠系膜水肿、出血,肠系膜淋巴结肿大
四、病理变化
病理变化局限于大肠、回盲结合处。大肠黏膜肿胀,并覆盖着黏液和带血块的纤维素。大肠内容物软至稀薄,并混有黏液、血液和组织碎片。当病情进一步发展时,黏膜表面坏死,形成假膜;有时黏膜上只有散在成片的薄而密集的纤维素。剥去假膜露出浅表糜烂面。由于大肠病理变化导致黏膜吸收机能障碍,使体液和电解质平衡失调,发生进行性脱水、酸中毒和高血钾,这可能是本病引起死亡的原因。其他脏器无明显病理变化。
组织学变化:在早期病例,黏膜上皮与固有层分离,微血管外露而发生灶性坏死。当病理变化进一步发展时,肠黏膜表层细胞坏死,黏膜完整性受到不同程度的破坏,并形成假膜。在固有层内有多量炎性细胞浸润,肠腺上皮细胞不同程度变性、萎缩和坏死。黏膜表层及腺窝内可见数量不一的猪痢疾短螺旋体,但以急性期数量较多,有时密集呈网状。病理反应局限于黏膜层,一般不超过黏膜下层,其他各层保持相对完整性。

图3 慢性病例腹泻 粪便呈水泥样稀便 有坏死的组织碎片
五、诊断
根据特征性流行规律、临诊症状及病理变化的特点可以做出初步诊断。一般取急性病例的猪粪便和肠黏膜制成涂片染色,用暗视野显微镜检查,每视野见有3~5条短螺旋体,可以做定性诊断依据。但确诊还需从结肠黏膜和粪便中分离和鉴定致病性猪痢疾短螺旋体。分离本菌多采用添加壮观霉素(400μg/ml)等抑菌剂的胰胨大豆琼脂,加入5%~10%牛或马血液,采用直接划线或稀释接种法,于1.103×105Pa下(80%H2+20%CO2)以钯作为催化剂的厌氧环境中38~42℃培养,每隔2d检查一次,当培养基出现无菌落β溶血区即表明有本菌生长,经继代分离培养,一般经2-4代后即可纯化。进一步鉴定可做肠致病性试验(口服感染试验猪和结肠结扎试验),若有50%的感染猪发病,即表示该菌株有致病性。结扎肠段接种菌悬液,经48~72h扑杀,见肠段内渗出液增多,内含黏液、纤维素和血液,肠黏膜肿胀、充血、出血,抹片镜检有多量短螺旋体,则可确定为致病性菌株,非致病性菌株肠段无上述变化。也可用PCR的方法进行病原体的快速鉴定。
血清学诊断方法有凝集试验、间接荧光抗体、被动溶血试验、琼扩试验和ELISA等,比较实用的是ELISA和凝集试验,主要用于猪群检疫和综合诊断。
类症鉴别:本病应注意与下列几种病进行鉴别。
(1)沙门氏菌病:为败血症变化,在实质器官和淋巴结有出血或坏死,小肠内可发现黏膜病理变化,肠道深在性溃疡,都是沙门氏菌病的重要特性。确诊应根据大肠内有无猪痢疾短螺旋体,和从小肠或其他实质器官中分离出沙门氏菌来确定病性。
(2)猪增生性肠炎:本病病理变化主要见于小肠,确诊在于增生性肠炎病理变化特点和肠上皮细胞有劳氏胞内菌的存在。
(3)结肠炎:由结肠菌毛样短螺旋体引起,临诊症状与温和性猪痢疾相似,但剖检病理变化局限于结肠,确诊依靠结肠菌毛样短螺旋体的分离鉴定。
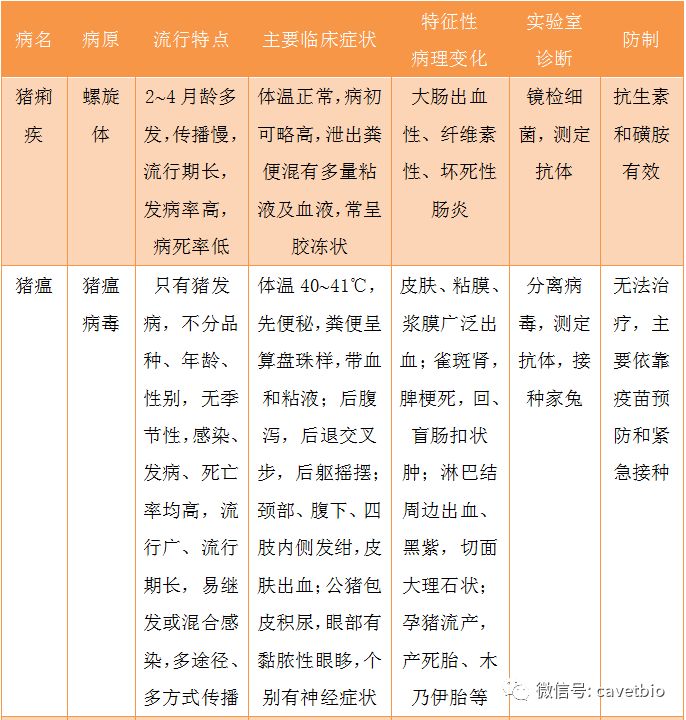
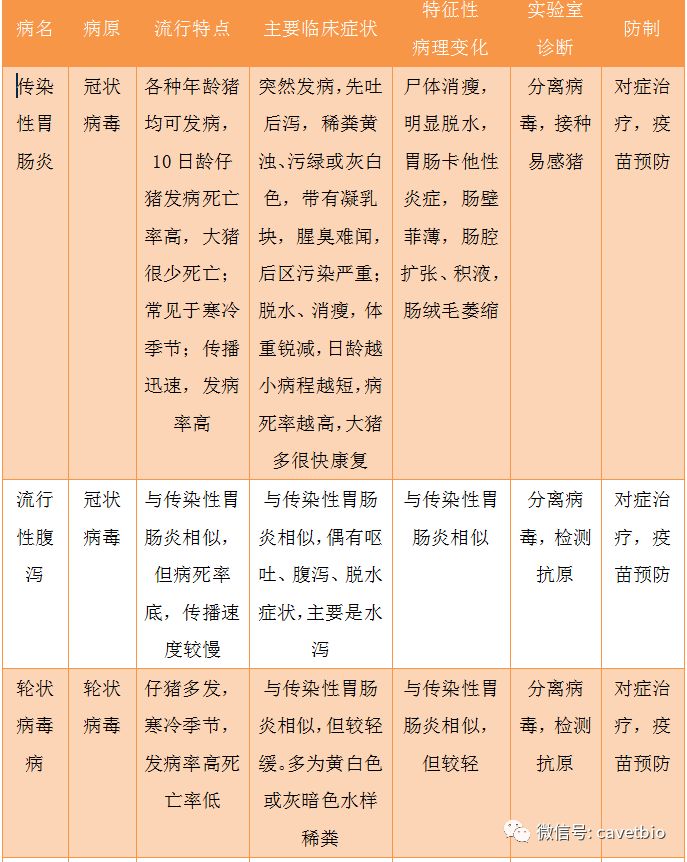
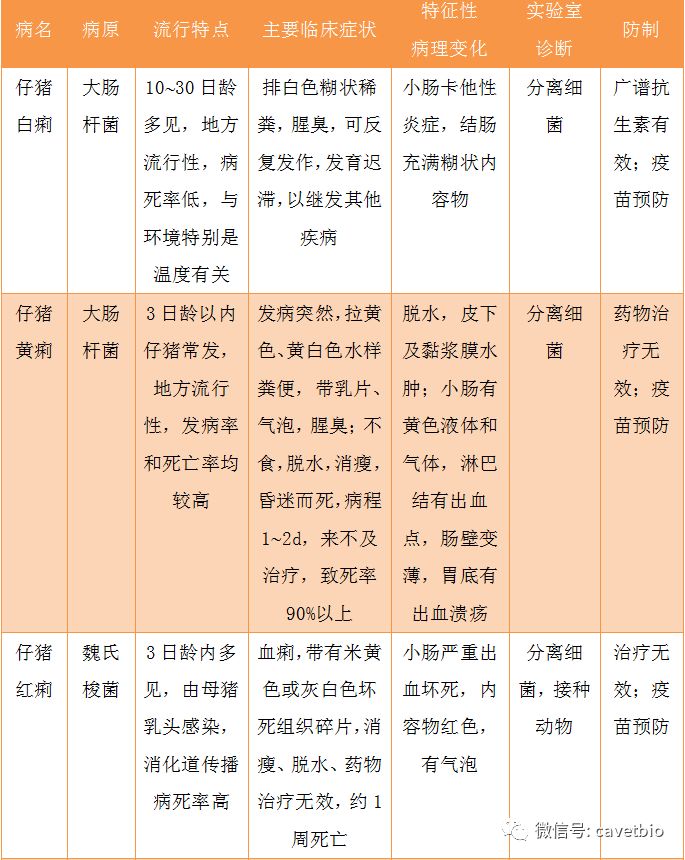
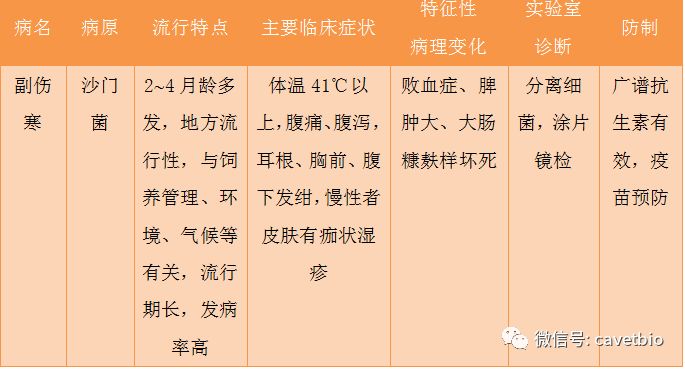
另外,还应注意与猪瘟、传染性胃肠炎、猪流行性腹泻及其他胃肠出血的鉴别(见表1)。
表1有腹泻症状的猪传染病的鉴别诊断
六、防制
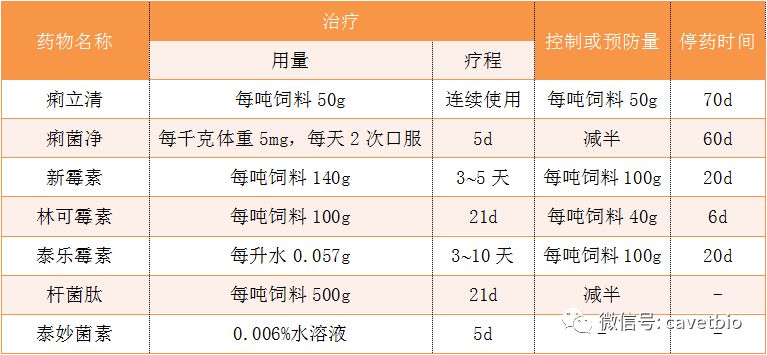
至今尚无菌苗可用,因此控制本病主要采取综合防制措施。严禁从疫区引进生猪,必须引进时,应隔离检疫2个月;猪场实行全进全出饲养制,进猪前应按消毒程序与要求对猪舍进行消毒,加强饲养管理。保持舍内外干燥,防鼠灭鼠,粪便及时做无害处理,饮水应加含氯消毒剂处理。发病猪场最好全群淘汰,彻底清理和消毒,空舍2~3个月,再引进健康猪。对易感猪群可选用多种药物进行防制,具体方法见表2。结合清除粪便、消毒、干燥及隔离措施,可以控制甚至净化猪群。
表2 猪痢疾的药物防治方法
汇编销售公司 刘俊
2
浅谈无血清培养基的组成及作用
随着细胞培养的种类、规模和应用范围的不断扩大及对安全性要求的进一步提高,无血清培养技术的研究已经成为细胞工程领域的重要课题。细胞无血清培养基的升级换代以及配方研究、开发和优化,促进了当今生物医药产业不断发展。本文主要对无血清培养基的成分及作用进行阐述。
一、无血清培养基的发展
Harry Eagle于1955年首次提出细胞培养基的主要成分,是一个包含无机盐、氨基酸、糖、维生素及其它必须营养物质的等渗透压且具有pH缓冲能力的混合物。随后进行改进,便诞生了MEM培养基。这款培养基在支持细胞生长时,需加入10%以上的血清。直到1997年,Gibco首次推出了CDM培养基,此培养基化学成分确定,不含血清、不含水解物、不含蛋白,开创了无血清培养基开发的先河。
为提高无血清培养基的性能,研究者开发了各种血清或血浆的提取物。其中,科恩分步分离法的过程中会产生一个副产物,具有促进细胞生长的潜能,可代替培养基中的全血清,促进MDCK细胞的生长。此类替代物可在细胞培养中用来设计成无血清培养基。

随后,出现了蛋白水解物。它们从动物组织、牛奶或植物如大豆、小麦或大米中提取,最终的产物是维生素、脂类、矿物质和双/三肽,这就为细胞生长提供了丰富的基础氨基酸来源。它常作为基础培养基的添加剂替代血清,常用于培养CHO、杂交瘤、BHK、Vero和淋巴细胞等细胞系。尽管含有蛋白水解物的无血清培养基有很大优势,但是批间差异性依然存在,且动物来源的水解物可能存在病毒或朊病毒的污染风险,限制了其大规模生产应用。
于是,适合大规模生产的化学成分确定的培养基应运而生,此培养基成分已知、无蛋白、无水解物、特殊的设计与优化,能最大限度的提高悬浮培养物中细胞系的生长和蛋白质表达、批次间一致性和稳定性高、无动物来源成分、外源物较低、便于审查、有可靠的保障,也为未来无血清培养基的发展奠定了基础和方向。
二、无血清培养基的组成和作用
2.1
葡萄糖
葡萄糖是动物细胞培养基中主要添加的糖,其含量在5-25mM之间。葡萄糖主要通过糖酵解代谢成丙酮酸,进而降解成乳酸,乳酸则在培养基中积累。另外,一小部分(约20-30%)葡萄糖则通过三羧酸循环和戊糖磷酸途径代谢。
研究发现,除葡萄糖为动物细胞提供能量外,谷氨酰胺也可作为动物细胞的能量物质,也是细胞系生长的所需物质。在多数情况下,细胞生长会快速利用谷氨酰胺和葡萄糖,消耗到一定量时,细胞便会出现生长抑制。
2.2
氨基酸
不同细胞系所需的特定营养不同,所需的氨基酸也不同。细胞系在体外培养时自身不能产生相应的氨基酸或产生量不足,无法满足自身生长所需,从而限制自身生长。细胞的生长速率与细胞密度均与氨基酸有密切的关系。因此,必须在培养基中定量加入特定氨基酸并维持其浓度是十分重要的。另外,支链氨基酸的含量也不可忽视。在大规模细胞培养中,补料策略非常重要。
2.3
盐
在细胞培养中,通常在培养基中加入Na+、K+、Mg2+、Ca2+、Cl-、SO42-、PO43-和HCO3-等盐溶液以维持渗透压的平衡。一般在培养基中细胞生长标准渗透压是270-300mOsm/kg,盐浓度的改变会引起培养基渗透压的变化,进而影响细胞的生长。因此,要特别注意培养基中盐的浓度。
2.4
微量元素
细胞生长所需微量元素有Mn、Cu、Zn、Mo、Va、Se、Fe、Ca、Mg、Si、Ni以及Al、Ag、Ba、Br、Cd、Co、Cr、F、Ge、J、Rb和Zr等一些不常用的微量元素。微量元素可通过激活酶的活性来维持细胞的生长。还有些微量元素具有抗氧化和促进细胞生长的功能,如硒。在某些情况下,特定微量元素的加入会降低对某种生长因子的需求,如亚铁盐。还有些微量元素可参与细胞增殖活动,促进信号转导、细胞分裂和细胞黏附等过程,如钙。因此,在一般培养基中添加血清便是在补充这些无机微量元素。
2.5
维生素
维生素与荷尔蒙在细胞培养中作为辅助因子被利用,相对浓度较低,细胞系不同,营养需求不同。因此,不同的培养基对此种辅助因子的需要量也有较大的差异。维生素主要与细胞的生长和存活有关,但却不影响细胞的最高生长密度。
不同培养基中的维生素含量及种类会有所不同,这也是为了更好的适应细胞的生长。如BME培养基含有生物素、叶酸、尼可酰胺、泛酸盐、吡哆醛、核黄素和硫胺;而F12、DMEM、M199等无血清培养基中,维生素的种类则更多。维生素的种类及含量均是根据具体的细胞系和长期的试验结果来添加的,视具体情况而定。
2.6
缓冲盐
HCO3--CO2(5-10%)缓冲系统常被用于细胞培养中,此缓冲系统可使培养基的pH维持在6.9-7.4,以利于细胞的生长。但HCO3--CO2缓冲系统也存在着缺点,一旦离开CO2的环境,培养基会迅速变为碱性而阻碍细胞的生长。为防止这种情况发生,一般会在培养基中加入有机缓冲液Hepes(pH7.0),并保持其浓度在25mM,这样可使得CO2的浓度降低至2%,以维持细胞正常的生长环境。

2.7
生长因子
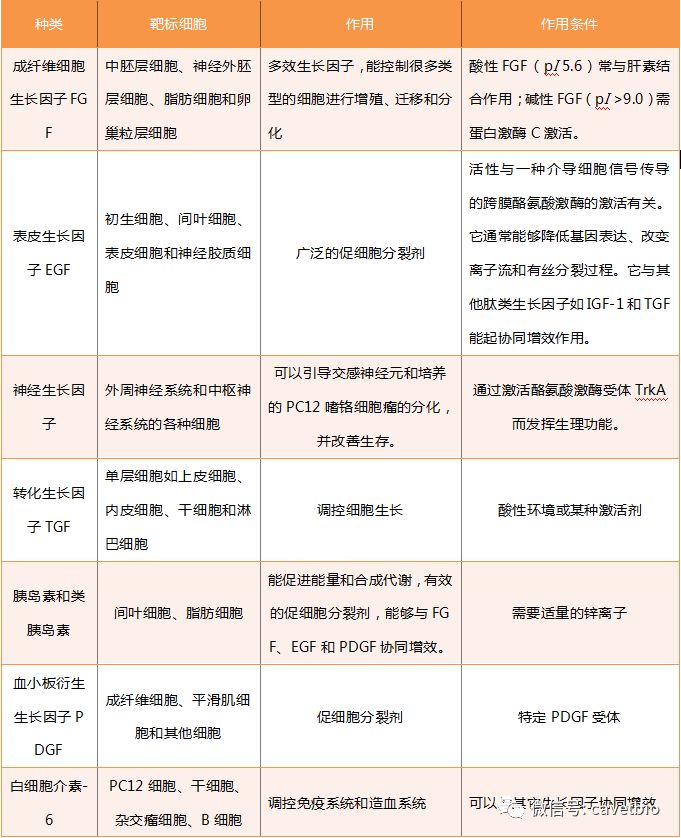
在无血清或低血清的培养基中,为促进细胞生长,经常会在培养基中添加一些特定的蛋白,以便为细胞生长提供物质基础,他们被称为“生长因子”。常见生长因子如下表,这些生长因子在1-10ng/mL的范围内均有活性。
表1 常见生长因子及其作用
2.8
脂类
脂类只有少部分作为添加剂被添加到无血清培养基中,发挥着促进细胞增殖的作用。而基础培养基的配方通常是不含脂类的。在血清中,脂类有脂肪酸、磷脂、卵磷脂和胆固醇。磷脂作为细胞膜的主要构件,可调节生长的信号传导。在细胞外,磷脂可促进多种细胞系的生长,如MDCK、小鼠上皮细胞和其它肾细胞。在无血清培养基中,特定的脂类也有促进生长作用,也能提高生长速度和产量。
三、展望
无血清培养基的快速发展和持续更新,尤其是化学成分确定的培养基的开发,极大的降低了生物制药的成本,减少了生产工艺过程中外在的风险,优化了生物仿制药的质量,改善了抗体的电荷异构体和糖型,从而加速了生物仿制药的开发和上市,期望无血清培养基在今后能更好的促进生物制药行业的发展。
销售公司 李小明编审 李冬
3
白细胞介素及其生物学活性
白细胞介素属于一类细胞因子,是由多种细胞分泌且可作用于多种细胞。由于此类细胞因子在白细胞外起作用,通常称它们为白细胞介素。它们和血细胞生长因子都属细胞因子,两者相互作用,相互协同完成造血和免疫调节功能。白细胞介素主要功能包括信息传递、免疫细胞的激活与调节、诱导T细胞与B细胞活化增殖分化以及调节炎症反应。
许多白细胞介素不仅作用于白细胞,还可作用于其他细胞,例如介导造血干细胞、血管内皮细胞和神经细胞在维持机体的各种功能中起到一定的作用。

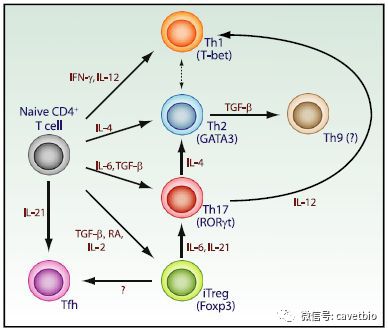
1. 种类和结构
在免疫学研究过程中,学者们发现了许多生物活性分子,并根据其相关的生物活性命名。随着分子生物学技术的迅速发展,人们发现白细胞介素属于同类物质,且具有多重作用。
1979年,在第二届国际淋巴因子的会议上,将作用于白细胞间的一些细胞因子命名为IL。 它们以阿拉伯数字命名,例如IL-1、IL-2、IL-3等,并且不断增加新的IL。 绝大多数IL是小分子的分泌多肽,并且少数以膜结合的形式存在于细胞表面。它们主要以糖蛋白的形式存在,含有不同程度的糖基侧链,不同的糖基与IL在体内的半衰期有一定的相关性,但对它的功能不产生影响。 从氨基酸序列来看,IL之间存在很大差异,但就基因调控而言,它们有很多共同点,这表明它们的基因表达是相互关联的。
白细胞介素需与细胞表面的相应受体相结合后才能起到作用。近年来,大多数白细胞介素受体基因被成功克隆,对其结构及信号传导有了一定的认识。与其它膜表面受体一样,白细胞介素受体以单链、双链或三链形式存在,受体由三个功能区域组成,即膜外区域(IL结合区域)、跨膜区(疏水性氨基酸富集区)和膜内区(信号转导区)。
2. 生物学活性
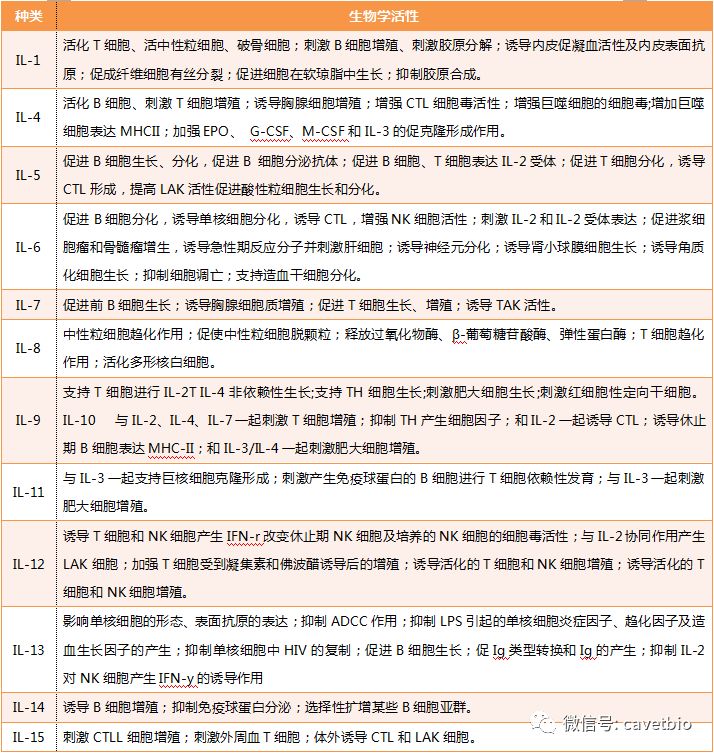
IL具有多种生物学活性,可诱导相应细胞的增殖和分化、增强机体抗感染和细胞杀伤效能、调节其它细胞因子和膜表面分子的表达、调理炎性反应、维持细胞生命活动等。异质性和网络性是白细胞介素的主要特点,单一IL对多种免疫细胞或非免疫细胞作用,同时多种IL可作用于同一种免疫细胞,不同细胞因子可相互作用,而它们本身又受到机体内多种因素的影响,由此构成了复杂的免疫调节系统,部分白细胞介素的具体生物学特性详见表一。
2.1 免疫应答
免疫细胞之间存在纵横交叉的调节关系,白细胞介素作为信息分子调节免疫细胞的作用关联。反之,B细胞产生一些调节T细胞活性的白细胞介素。许多免疫细胞产生的白细胞介素具有调节自身的作用。例如IL-2,由T细胞产生,刺激T细胞进一步产生IL-2分泌。 研究IL的免疫过程中的调节作用,可以更全面的认识免疫机制,有助于治疗由免疫缺陷引起的疾病。与补体等分子相比,白细胞介素作用效力高,作用时间短,在抗肿瘤、抗感染、移植排斥等方面发挥着重要作用。
2.2 促进炎症反应
炎症反应是由机体的外部刺激引起的病理变化,可产生大量炎症细胞,局部浸润巨噬细胞,引起组织坏死。IL在炎症过程中起重要作用,可以激活和聚集炎性细胞,伴随炎症介质的释放,引起身体发热。IL-8可以使中性粒细胞向炎症部位趋化,加重炎症引起的症状,可以在许多炎性疾病中监测到较高的IL水平。将一些IL注射到动物体内,发现IL直接诱导炎症,从而证明IL在炎症过程中起重要作用。
2.3 刺激造血功能
研究表明,IL-3是一种细胞因子,可作用于造血干细胞的早期阶段,IL-7作用于淋巴造血细胞,血小板生成素(TPO),IL-6和IL-11作用于巨核细胞造血细胞。这表明IL参与从造血干细胞向成熟免疫细胞分化的每个步骤。目前,多种刺激造血功能的IL已成功应用于血液病的临床治疗,并已显现出良好的治疗效果。
2.4 其它
除参与免疫系统的调节外,许多IL参与非免疫系统的调节。 如IL-8具有促进新生血管形成的作用;IL-1刺激破骨细胞和软骨细胞的生长;IL-6促进肝细胞急性期蛋白的表达。
表一 部分白细胞介素的生物学活性
3、小结
白细胞介素是一类非常重要的细胞因子家族,目前已发现33种,它们具有非常重要的生物学活性,在免疫细胞成熟、活化、增殖和免疫调节等生命过程中起重要作用,并参与机体其它生理和病理反应。一些白细胞介素已在体外合成成功,同时在临床上得到了应用,可预防和治疗免疫性疾病及炎性疾病,进而维持体内的生理生化平衡。随着科学技术的不断进步,人们对白细胞介素的研究越来越深入,更加明确了它的作用机制,从而为人类及动物健康提供有力保障。
销售公司 杨儒爱编审 李冬
4
牛病毒性腹泻-粘膜病的诊断和防治
牛病毒性腹泻-粘膜病(BVD)又称粘膜病,是由牛病毒性腹泻病毒(BVDV)引起的一类可感染牛的急性、热性传染病。其较明显的临床症状为发热、食欲下降、腹泻、怀孕率降低、怀孕动物产下死胎、畸形体。1946年,美国学者Olafson首次发现该病毒,随后在世界各地呈流行趋势,对全球的乳业和动物养殖业造成了巨大的经济损失。同时,由于该病毒在基因结构和抗原特性方面与猪瘟病毒存在较高的同源性,因此该病毒也可以传染猪、羊等其他动物,不同物种间的交叉感染给该病的临床诊断和检测造成极大的困扰,更成为根除BVDV所面临的巨大挑战。
一、BVDV病原学
牛病毒性腹泻-粘膜病毒属黄病毒科、瘟病毒属,为单股正链RNA病毒,由球状的病毒颗粒包裹磷脂双分子层组成,直径35-55nm,对酸碱性、温度和有机溶剂(乙醚和氯仿)较敏感,PH3.0以下易裂解,26℃-37℃存放24h毒性下降,56℃可灭活,在低温条件下具有较强的稳定性,-60℃或冻干可存放数年。
BVDV基因组全长12-13Kb,根据其基因组5'端的序列不同,将其分为BVDV-1和BVDV-2两种基因型。NY-1、NADL、CV24及Singer株等传统毒株属于BVDV-1型,与牛出血综合症相关的其他毒株属于BVDV-2型,目前BVDV-1型毒株被普遍应用于疫苗的研发和诊断。另外根据该病毒感染细胞后,能否导致细胞发生病变,分为致细胞病变型和非致细胞病变型,两种病毒可能在RNA的参与下进行转化,但其主要以非致细胞病变型存在。
二、 BVD的流行病学和临床症状
牛病毒性腹泻,其自然感染的潜伏期为7-10d,人工感染的潜伏期为2-3d,
该病主要通过患病的动物体和病毒携带者传播,也可通过粪便、血液、其他组织及商用生物制剂传播。该病的发病和流行主要以冬、春季为主,且对各种年龄和品种的牛均有易感性,每年因感染BVDV而死的牛占总数的0.5%-1%,感染的妊娠母畜产下的胎儿可终生排毒或造成畸形胎儿,给养殖户带来了巨大的经济损失。根据动物体患病表现,其临床症状主要包括腹泻型、粘膜型和胎儿感染型三种。
1. 急性腹泻型
在临床上急性病毒性腹泻为最常见的一种病症。发病动物体体温升高,呈持续性腹泻,白细胞减少,同时口腔、食道、胃部及肠部粘膜发生糜烂,排泄物内含血液或黏液。在爆发初期,患病动物会出现跛行现象,牛群中近25%-35%患有蹄叶炎,蹄壳变形,走路痛苦,有的会出现体重下降,角膜混浊等现象,幼犊的死亡率高于成年牛,发病动物存活期较短,一般不超过1个月。
2. 慢性粘膜型
病畜不会出现明显的体温升高的现象,主要表现为食欲不振,鼻镜糜烂,眼部出现浆状分泌物,齿龈发红及间歇性的腹泻,发病几天后出现跛行现象,此种病症较明显,死亡率高,病畜存活期一般为6-12个月,是比较严重的一类临床症状。
3. 胎儿感染型
该病可严重影响牛的繁殖能力,导致妊娠母牛流产、胎儿死亡、畸形胎儿及弱胎等,同时也会导致奶牛产奶量和质量下降,从而降低生产性能。
三、诊断技术
1. 血清学检测
主要包括血清中和试验、免疫琼脂扩散试验、免疫过氧化物酶试验、免疫荧光技术及酶联免疫吸附试验(ELISA)等,其中血清中和试验和酶联免疫吸附试验是检测BVDV有效的方法。血清中和试验可进行多次血清滴度检测,可定性也可定量,检测方便灵活,重复率高,但病毒的感染过程较复杂;ELISA是检测BVDV和体内抗体水平常用的方法,主要通过物理方法将已知的抗原或抗体吸附在固相表面,用酶标记抗原或抗体,使抗原抗体在固相表面发生反应,通过测定免疫酶判定结果,此方法快速、简便,适用性强,可应用于规模化养殖场BVDV 检测和流行病学调查。
2. 环介导等温扩增技术(LAMP)
LAMP是近几年兴起的一种新型核酸等温扩增技术,主要针对BVDV 5'端的UTR基因设计LAMP引物,特异性识别靶序列,通过实时浊度仪检测LAMP反应过程中产生的焦磷酸镁沉淀,根据浊度曲线的变化规律来判定结果,该方法特异性强、重复性好、灵敏度较PCR高,且检测方法简单快速,更适用于BVD的快速临床诊断。
3. 聚合酶链式反应技术(PCR)
目前较常用的PCR技术主要为转录-聚合酶链式反应技术(RT-PCR)和实时荧光定量PCR技术(qPCR)。RT-PCR技术是根据已知的BVDV基因序列设计特异性引物,提取BVDV的RNA,进行一步法RT-PCR扩增,扩增产物测序后与参照BVDV序列进行同源性比较。此检测方法操作简单,反转录与目的基因扩增可一步完成,大幅度地节约了时间。另有学者通过优化PCR反应条件,建立了双重RT-PCR法,可同时对两种病毒进行检测,为检测两种病毒交叉污染提供了有效、快捷的方法。
qPCR技术是根据病毒分子的特异性序列,设计引物,同时在PCR反应体系中加入荧光基团,通过荧光信号的积累对整个PCR 过程进行监控,运用标准曲线法对未知模板定量分析。此检测方法较RT-PCR灵敏度高,且试验结果通过Ct值的大小来反应,避免了传统的凝胶电泳带来的污染问题。但qPCR需要在荧光PCR仪中进行,对仪器要求较高,有时会出现假阳性情况,因此适用性不强。
四、防控及治疗
1. 免疫接种
目前,疫苗接种仍然是预防疫病发生的有效途径。运用弱毒疫苗对可能发病的牛群进行定期接种,成年的母牛和公牛在配种前接种,对断奶前后数周的牛也要进行预防接种。目前国内普遍采用的是猪瘟兔化组织疫苗,免疫效果好,安全性高,可在配种前定期接种。

2. 对持续性感染动物及时鉴别诊断,采取扑杀措施
持续性感染的动物体,用血清学试验无法检测出有效抗体,因此在初期免疫的基础上,应对动物体进行常规血清检测,抗体滴度低于1:64或无抗体,表明为持续性感染动物。应及时对病毒分离并采取隔离措施,甚至扑杀,以防疾病传播。
3. 注意饲养管理,做好日常疫病监测
及时清理动物活动场所排泄物,定期对牛舍和所用器具消毒,创造良好的饲养环境,同时合理搭配饲料,确保营养物质均衡。
4. 药物治疗
对患病动物体,可注射一定量的抗生素,减少继发性感染。若幼年牛出现感染症状,可定期进行电解质和水的补充。同时可根据具体病情和症状,使用消炎、退烧及止泻药物。
总之,牛病毒性腹泻病对养殖业的发展造成了严重的影响,且受染对象广泛,但目前还没有有效的根治方法,只能通过综合运用各种检测方法及时对疫病进行鉴定分离,采取适当的治疗措施,从根本上提高养殖户的防疫意识,定期免疫接种,同时加强养殖区域的监督管理,最大限度的减少牛病毒性腹泻病的危害。
生产部 葛玉凤编审 王同淑